Какие витамины пить при диализе
ПРАВИЛА ПИТАНИЯ ПРИ ЛЕЧЕНИИ ГЕМОДИАЛИЗОМ
В. М. Кузнецова ООО «Ярославский диализный центр»
Гемодиализ – метод лечения больных хронической почечной недостаточностью (ХПН), основанный на диффузии из крови через полупроницаемую мембрану азотистых шлаков и других веществ, задерживающихся в крови при уремии. Гемодиализ проводят аппаратом «искусственная почка» с помощью диализирующих растворов.
Регулярный гемодиализ не заменяет в полной мере утраченные функции почек, и у больных сохраняется ряд нарушений обмена веществ, свойственных ХПН. Кроме того, диализная терапия имеет побочные эффекты, ведущие, в частности, к потерям ряда питательных веществ. Поэтому состояние больных, находящихся на хроническом гемодиализе, во многом определяется правильной диетотерапией. Напомним, что здоровые почки работают 24 часа в сутки, а искусственная – только 3 раза в неделю по 4 часа. Поэтому необходимо строго следить за тем, чтобы в период между сеансами диализа организм не получал избытка токсических веществ и жидкости. Несоблюдение предписанного режима питания может привести к тяжелым осложнениям: отеку легких, отеку мозга или даже летальному исходу.
Принципы питания при регулярном гемодиализе
1. Потребление белка и энергии.
Ведущим вопросом диетотерапии является количество и качество белка в рационе больных, получающих диализную терапию. Этот вопрос тесно связан с энергоценностью рациона, так как улучшение азотистого баланса может быть достигнуто только при одновременном увеличении потребления белка и энергии.
Достаточно высокое количество полноценного белка в диете определяется потерями белка и аминокислот, обусловленными диализом, остаточной протеинурией, гиперкатаболизмо м белка и угнетением его синтеза в организме, ухудшением пищеварения. Так, при гемодиализе потери белка могут достигать 5 – 8 г за одну процедуру гемодиализа. Недостаточное потребление больными белка и источников энергии в связи с анорексией также обусловливает необходимость его дополнительного включения при диализе.
Максимальный уровень потребления белка рекомендуется при осложнениях – инфекции, кровотечения и др. Однако, избыточное содержание белка в рационе ведет к увеличению азотистых шлаков, гиперфосфатемии, метаболическому ацидозу и нарастанию клинических симптомов уремии. Альтернативой является использование препаратов незаменимых аминокислот и (или) кетокислот, например, «Кетостерила».
Источником полноценного белка в диетах при гемодиализе должны быть нежирное мясо и умеренно жирная рыба (120 – 150 г брутто) в виде различных блюд после отваривания. Яйца (2 – 3 шт. в день), в умеренном количестве молоко, сливки. Кисломолочные напитки (100 – 200 г), сметана (100 – 200 г), творог 20 – 40 г. Указанные величины имеют сугубо ориентировочный характер.
Таким образом, диета пациента с нормальной для него массой тела 70 кг должна содержать в среднем 70 – 85 г белка (60 – 70% — животного происхождения). Энергоценность диеты должна составлять для такого пациента в среднем 2500 – 2800 ккал.
2. Потребление жиров и углеводов.
Вопрос о составе жиров и углеводов в диете при гемодиализе имеет важное, хотя и не первостепенное значение. При диализной терапии наблюдаются нарушения липидного и углеводного обмена, связанные с изменением эндокринной функции почек, гормональным дисбалансом, изменением чувствительности тканей – мишеней к гормонам при ХПН. Нарушение липидного обмена способствует развитию атерогенной сердечно-сосудис той патологии. Гемодиализ незначительно нормализует липидный спектр крови при ХПН, и только диета с ограничением легкоусвояемых углеводов приводит к уменьшению гипертриглицерид емии.
Таким образом, питание при диализной терапии не следует перегружать жирами и углеводами. Необходимо включать в рацион источники полиненасыщенных жирных кислот семейства омега – 6 (растительные масла) и омега – 3 – жиры морской рыбы.
Указанные особенности состава жиров и углеводов важны для нормализации липидного обмена. При плохом аппетите и самочувствии больных допускается увеличение потребления легкоусвояемых углеводов (мед, варенье, некоторые кондитерские изделия и др.), если это приятно больному и обеспечивает нужное потребление энергии.
Суточная потребность жиров составляет, в среднем, 110 г. Разрешается масло сливочное и растительное. Тугоплавкие жиры исключаются. Суточная потребность углеводов 450 г.
3. Потребление натрия и свободной жидкости.
Эти потребности зависят от уровня артериального давления, степени задержки воды в организме. С началом лечения регулярным гемодиализом количество выделенной мочи, как правило, непрерывно снижается. У диализных больных с олиго- и анурией натрий выводится из организма только путем ультрафильтрации , поэтому в промежутках между сеансами гемодиализа натрий в организме задерживается. При этом усиливается жажда и потребление жидкости, что способствует возникновению отеков вплоть до нефрогенного отека легких, а также артериальной гипертензии. Поэтому при гемодиализе потребление натрия ограничивают до 2 г/сут, что соответствует 4 – 5 г поваренной соли.
Употребление 9 г соли в сутки приводит к задержке в организме воды около 1 л воды!
Содержание натрия в 100 г съедобной части продуктов
Источник
ДИЕТА НА ГЕМОДИАЛИЗЕ
Гемодиализ является методом лечения больных с терминальной стадией хронической почечной недостаточности, суть которого заключается в использовании аппаратных методов очищения организма больного от токсических веществ и в нормализации водно-солевого баланса.
Столкнувшись с проблемами работы внутренних органов, приходится в значительной степени менять весь свой образ жизни. Особое внимание уделяется питанию. Оно должно не только не вредить выздоровлению, но и способствовать этому. В этих целях разработаны десятки диет, которые используются при том или ином заболевании.
Диета при гемодиализе почек создана еще в восьмидесятых годах прошлого века, но она актуальна и по сей день, активно используется как часть общей системы лечения.
Очень важный параметр — Индекс массы тела (ИМТ) — который должен знать о себе каждый человек!
Как его рассчитать :
Вес (кг) / (Рост (м))х2
Вес человека — 75 кг.
ИМТ = 75/ (1,75)х2 = 24,48
Ожирение – это фактор риска, который неизбежно приведет к развитию тяжелых заболеваний и осложнений.
Самые вредные продукты по версии ВОЗ:
1. Чипсы и картофель-фри
4. Супы, лапша, пюре быстрого приготовления
5. Майонез, кетчуп
6. Шоколадные батончики
7. Газированные напитки и сладкие соки (глюкозо-фруктозный сироп)
Рекомендации по продуктам
Хлеб, мучные изделия Разрешено потребление 150-200 г пшеничного и ржаного бессолевого хлеба. Запрещены все остальные виды хлеба и изделия из муки.
Супы Допускаются в пищу вегетарианские супы с добавлением разных овощей, борщи, свекольники, щи со свежей капустой в количестве до 250 г. В ограниченных количествах можно кушать супы с крупами и молочные супы. Запрещено потребление мясных, рыбных, грибных бульонов.
Мясо, птица, рыба Разрешено потребление до 100 г брутто нежирных сортов говядины, телятины, крольчатины, индейки, курицы, рыбы, которые можно отваривать, а потом запекать или поджаривать куском или в рубленом виде. Запрещены колбасы, соленая рыба, копченые продукты, консервы, икра.
Молочные продукты Содержание молокопродуктов ограничивается. Разрешено потребление в среднем 140 г молока в день, такого же количества сметаны и 25 г творога. За счет молока можно увеличить потребление сметаны до 200 г в день. Запрещены сыры.
Яйца В день можно скушать 2-3 яйца, приготовленных всмятку, в составе омлетов и других блюд.
Крупы Количество круп ограничено. Предпочтение отдается саго и рису, с которых можно готовить фруктовый плов, запеканки, иногда — гарниры. Запрещено потребление бобовых культур.
Овощи Рекомендовано потребление в среднем брутто 300 г картофеля и 400 г капусты белокочанной, моркови, свеклы, огурцов, помидоров, салата, лука зеленого, укропа, петрушки, которые можно подавать в виде разнообразных блюд и гарниров. Запрещены бобовые культуры, соленые, квашеные, маринованные овощи, ревень, щавель, шпинат, гри
Закуски Допускаются в пищу овощные и фруктовые салаты, винегреты. Запрещены соленые и острые закуски.
Плоды, сладкое, Фрукты и ягоды можно употреблять в сыром, запеченном или вареном виде. Разрешены муссы, желе, кисели. В пищу допускаются сахар, мед, варенье. Ограничено потребление абрикос, винограда, персиков, черешни, черной смородины, инжира, бананов. Запрещены сухофрукты, шоколад, кондитерские изделия.
Соусы, пряности Разрешено потребление молочного, сметанного, томатного соусов, сладких и кислых овощных и фруктовых подлив. Не запрещено использование лимонной кислоты, ванилина, а в ограниченном количестве и хрена, горчицы, перца, корицы. Запрещено потребление мясных, рыбных, грибных соусов.
Напитки Пить можно чай, некрепкий кофе, отвары шиповника и пшеничных отрубей, соки из разрешенных овощей и фруктов. Запрещено какао.
Жиры Рекомендовано потребление 40 г масла сливочного, 35 г растительных масел в день. Запрещены тугоплавкие жиры.
ЧРЕЗМЕРНОЕ ПОТРЕБЛЕНИЕ СОЛИ СТИМУЛИРУЕТ ЖАЖДУ И НАБОР ЖИДКОСТИ.
Источник
Витаминно-минеральные добавки для диализных пациентов — Vitamin and mineral supplementation for dialysis patients
В здоровом состоянии почки отвечают за непрерывную фильтрацию крови, чтобы поддерживать баланс жидкости, электролитов и органических растворенных веществ в организме. Однако, когда почки повреждены, они больше не могут этого делать. Диализ , используемый при терминальной стадии заболевания почек (также называемой почечной недостаточностью , хроническим заболеванием почек и почечной недостаточностью), это процесс, при котором машина фильтрует кровь, поскольку почки больше не могут это делать. Помимо неспособности фильтровать кровь, почечная недостаточность приводит к неспособности организма вырабатывать некоторые витамины и минералы (например, витамин D), а также к затруднению выведения из организма чрезмерного количества определенных витаминов и минералов (например, фосфора).
Содержание
Роль почек в метаболизме витаминов и минералов
Обычно мы можем получать достаточное количество витаминов и минералов, употребляя самые разные продукты. Однако многие пациенты на диализе должны соблюдать ограничения в питании, что затрудняет получение необходимого количества определенных витаминов и минералов для сохранения здоровья. В дополнение к этому, многие витамины и минералы теряются в процессе диализа. Следовательно, многие пациенты на диализе подвержены риску дефицита витаминов и минералов. Поскольку витамины необходимы для правильного обмена веществ, образования белка и роста, для здоровья диализных пациентов важно, чтобы они получали любые витамины или минералы, в которых у них может быть дефицит.
Общий обзор витаминов и минералов
Витамины можно разделить на две группы: водорастворимые витамины и жирорастворимые витамины . Водорастворимые витамины включают витамин С и витамины группы В ( фолиевая кислота , тиамин , рибофлавин , ниацин , пантотеновая кислота , биотин , витамин B6 , витамин B12 ). Большинству диализных пациентов необходимо будет принимать добавки витаминов C и B, чтобы восполнить то, что теряется в диализном растворе. Жирорастворимые витамины включают витамины A , D , E и K . Избыточное количество этих витаминов может быть вредным для людей с почечной недостаточностью, поскольку они могут накапливаться в организме и становиться токсичными, поэтому их обычно не вводят диализным пациентам. Однако витамин D иногда является исключением из этого обобщения. При необходимости врач назначит витамин D.
Питательные вещества, которых следует избегать при диализе
Есть некоторые питательные вещества, которые ограничены у пациентов с почечной недостаточностью из-за неспособности организма выводить их чрезмерное количество из-за того, что почки не функционируют должным образом. В общем, эти питательные вещества включают:
- Калий : почки помогают регулировать уровень калия. Когда почки повреждены, уровень калия может повышаться. Повышенный уровень калия может вызвать нерегулярное сердцебиение или даже остановку.
- Фосфор : почки также помогают регулировать уровень фосфора в организме. Когда почки повреждены, они не могут удалить лишний фосфор, из-за чего он накапливается в крови. Ваш врач может назначить фосфат-связывающее средство, которое нужно принимать во время еды, чтобы помочь удалить избыток фосфора.
- Натрий : у пациентов с почечной недостаточностью натрий может вызывать чрезмерную задержку жидкости, что может привести к повышению артериального давления, отекам, сердечной недостаточности и одышке.
- Жидкость : по мере того, как ухудшается повреждение почек, увеличивается и способность выводить жидкость. У пациентов с почечной недостаточностью чрезмерное потребление жидкости может привести к тем же самым состояниям, что и чрезмерное потребление натрия.
Витамины и минералы для добавок при диализе
Многие продукты, содержащие фосфор и калий (ограниченные для диализных пациентов), также содержат фолиевую кислоту , ниацин , рибофлавин и витамин B6 (водорастворимые витамины). Следовательно, ограничение продуктов, содержащих фосфор и калий, может привести к дефициту других важных витаминов. Как правило, пациенты на диализе получают следующие витамины и минералы:
- Витамины группы B — водорастворимые витамины, которые играют роль в развитии красных кровяных телец, предотвращают анемию и способствуют метаболизму, помогая преобразовать пищу, которую вы едите, в энергию.
- Витамин C — водорастворимый витамин, который помогает поддерживать здоровье тканей, заживлять раны и предотвращать инфекции.
- Витамин D — Обычно почки превращают витамин D в его активную форму, витамин D3, который помогает усваивать кальций. Многие диализные пациенты получают низкое потребление кальция из-за отказа от продуктов, содержащих фосфор и калий. Недостаток кальция может привести к почечной остеодистрофии (ослаблению костей). С другой стороны, слишком много кальция может вызвать кальцификацию или кальцифилаксию (отложения кальция в таких местах, как сердце. Витамин D является жирорастворимым витамином, а это означает, что чрезмерное количество может быть вредным, поэтому его следует назначать и контролировать врачом.
- Железо. Повреждение почек приводит к неспособности почки вырабатывать эритропоэтин , который стимулирует выработку красных кровяных телец.
Питание пациентов на диализе варьируется в зависимости от индивидуальных особенностей. Попытка определить, какие витамины и минералы необходимо дополнять, а какие нет, может быть очень запутанной, поэтому для диализных пациентов важно поговорить с врачом, прежде чем вносить какие-либо изменения в свой план питания.
Источник
Опыт лечения тяжелых нарушений фосфорно-кальциевого обмена при терминальной почечной недостаточности с использованием цинакалцета
Хронические заболевания почек представляют собой серьезную проблему здравоохранения. Это определяется как неуклонным ростом числа больных с хронической почечной недостаточностью, так и высокой стоимостью и относительно неудовлетворительными исходами их ле
Хронические заболевания почек представляют собой серьезную проблему здравоохранения. Это определяется как неуклонным ростом числа больных с хронической почечной недостаточностью, так и высокой стоимостью и относительно неудовлетворительными исходами их лечения [1]. Анализ Базы данных пациентов с заболеваниями почек (USRDS) и результатов исследования NHANES III в США показал, что около 26 млн взрослых, то есть примерно 14,6% от числа населения старше 20 лет, страдают хроническими заболеваниями почек [4]. За последние пять лет число больных, находящихся на заместительной почечной терапии, увеличилось более чем на 25% и на данный момент составляет более 2 млн человек. При этом наибольшее количество больных, получающих заместительную почечную терапию, зарегистрировано в Японии (2230 пациентов на 1 млн жителей) и в США (1650 больных на 1 млн жителей). Наибольший рост числа таких пациентов зафиксирован в развивающихся странах (в том числе в России) — свыше 50% за 5 лет [6].
Исходя из данных о весьма значительной распространенности хронических заболеваний почек и динамике прироста терминальной стадии хронической почечной недостаточности в течение последних 20 лет эксперты прогнозируют и в будущем дальнейший рост численности этой категории больных, тем более что, благодаря значительному техническому прогрессу, заместительная почечная терапия в настоящее время может применяться практически без ограничений [4].
Проблема лечения терминальной стадии хронической почечной недостаточности усугубляется тем, что, несмотря на значительный прогресс в заместительной почечной терапии, ее прогноз все еще остается весьма неблагоприятным. В США сохраняется высокая годичная летальность пациентов, находящихся на заместительной почечной терапии, — более 20%. Ожидаемая продолжительность их жизни значительно короче, чем в сходной возрастной группе. Так, для пациентов в возрасте от 40 до 44 лет она составляет 7,1–11,5 года, а для пациентов от 60 до 64 лет — 2,7–3,9 года. Частота сопутствующих заболеваний у больных с хроническими заболеваниями почек также высока. Их среднее количество у больного, находящегося на заместительной почечной терапии, равно четырем, и основную роль при этом играют заболевания сердечно-сосудистой системы [22].
Пациенты с хроническими заболеваниями почек имеют большую вероятность умереть от осложнений своего заболевания, чем дожить до потребности в диализе. Летальность вследствие заболеваний сердца среди пациентов с терминальной стадией хронической почечной недостаточности в 10 раз выше, чем в общей популяции. Например, по данным американского регистра 2002 года у больных с почечной недостаточностью в 24,8% случаев выявлена ишемическая болезнь сердца, а в 8,7% — инфаркт миокарда [29]. У пожилых пациентов с хронической почечной недостаточностью частота ишемической болезни сердца выше на 22%, латентной ишемии — на 16%, а новых коронарных событий — в 3,4 раза по сравнению с пациентами без нарушения функции почек [6]. По данным исследования HOPE легкая почечная недостаточность (креатинин плазмы 124–200 мкмоль/л), независимо от других факторов риска и лечения, ассоциировалась с увеличением сердечно-сосудистой смертности от инфаркта миокарда и инсульта на 40% [25].
Предметом интереса недавних исследований стал вопрос, в какой мере сопутствующие сердечно-сосудистые заболевания могут быть связаны с нарушениями функции паращитовидных желез, развивающимися параллельно со снижением функции почек. Концепция, в соответствии с которой воздействие на рецепторы, подобные рецепторам паращитовидных желез, обнаруженные во многих органах и тканях, могут играть определенную роль в развитии и прогрессировании сердечно-сосудистых заболеваний у пациентов с хроническими заболеваниями почек, является относительно новой [2].
Вторичный гиперпаратиреоз при хронических заболеваниях почек
У пациентов с хроническими заболеваниями почек нарушенный синтез гормонально-активного витамина D в сочетании с длительной гиперкальциемией и повышенным уровнем фосфатов приводит к вторичному гиперпаратиреозу, одному из наиболее частых и тяжелых осложнений (около 30% пациентов, находящихся на программном гемодиализе) [12]. Это состояние, характеризующееся компенсаторной гиперсекрецией паратиреоидного гормона, приводит как к морфологическим изменениям паращитовидных желез, так и к развитию фиброзного остеита, потере костной массы и к сопутствующим сердечно-сосудистым заболеваниям [20]. Как правило, уровни паратиреоидного гормона в крови начинают повышаться при уменьшении скорости клубочковой фильтрации ниже 60 мл/мин/1,73 м2 [22]. К настоящему времени вопрос о времени появления у пациентов с хроническими заболеваниями почек сопутствующих сердечно-сосудистых заболеваний, их каузальной связи с дисфункцией паращитовидных желез и возможности обратного развития на фоне патогенетического лечения вторичного гиперпаратиреоза до конца не ясен [2, 3].
Давно известно, что паратиреоидный гормон оказывает воздействие на функционирование многих органов и систем [3]. При уремии, выделяясь в супрафизиологических концентрациях, он приобретает черты «универсального уремического токсина», вызывая плейотропную органную дисфункцию. Гиперсекреция паратиреоидного гормона способствует развитию ренальной остеодистрофии, уремической кардиомиопатии, «кальцификации миокарда», клапанов сердца и его проводящей системы, диффузному фиброзу миокарда, внескелетной кальцификации, артериальной гипертензии, ускорению развития атеросклероза, генерализованной васкулопатии, энцефалопатии; влияет практически на все стадии гемопоэза; нарушает секрецию инсулина [3, 15, 17, 20, 25, 31]. Эти события неразрывно связаны (по крайней мере, частично) с избыточной концентрацией паратиреоидного гормона и плохо корригируются заместительной почечной терапией.
Вторичная гиперплазия паращитовидных желез с повышением уровня паратиреоидного гормона в крови развивается практически у всех больных с хроническими заболеваниями почек. Вторичный гиперпаратиреоз у больных с хроническими заболеваниями почек — это компенсаторная гиперфункция паращитовидных желез, исходно направленная на поддержание физиологических параметров минерального и костного обмена, приводящая при прогрессировании почечной недостаточности к необратимым морфологическим изменениям (гипертрофии и гиперплазии главных клеток) паращитовидных желез [3].
Таким образом, своевременная диагностика, профилактика и адекватное лечение вторичного гиперпаратиреоза чрезвычайно важны для повышения качества и продолжительности жизни пациентов с хроническими заболеваниями почек.
Патогенез вторичного гиперпаратиреоза при хронических заболеваниях почек
Патогенез вторичного гиперпаратиреоза при хронических заболеваниях почек до конца не ясен и продолжает уточняться. В развитии вторичного гиперпаратиреоза играют роль разнообразные факторы, что приводит к запуску целого каскада биохимических и патофизиологических изменений, приводящих к необратимым морфологическим изменениям паращитовидных желез [2, 3, 22, 23]: транзиторная и/или персистирующая гиперфосфатемия (ретенция фосфатов); резистентность рецепторов органов-мишеней к паратиреоидному гормону; изменение метаболизма витамина D.
На сегодняшний день в целом остается верной гипотеза Bricker N.?S. (1972), в основу которой были положены представления о том, что при хронической почечной недостаточности главным стимулом к развитию вторичного гиперпаратиреоза является гипокальциемия, которая возникает в ответ на гиперфосфатемию, связанную с ретенцией фосфатов [7, 8]. При хронической почечной недостаточности, особенно в терминальной ее стадии, происходит патологическая фенотипическая модуляция рецепторов (в т. ч. из-за изменения молекулярной структуры и их количества) к ионизированному кальцию на поверхности клеток паращитовидной железы и других органов-мишеней (кость, кишечник, сосуды и прочее), что кардинально изменяет гомеостаз кальция. В результате происходит сдвиг секреторной set-point и клетки паращитовидных желез начинают высвобождать паратиреоидный гормон в ответ не только на низкую, но и на нормальную концентрацию ионизированного кальция в крови больного [5, 9]. Снижение концентрации в крови 1,25-дигидроксихолекальциферола и увеличение концентрации фосфатов также являются прямыми стимуляторами синтеза паратиреоидного гормона [7, 8].
Эти представления легли в основу широкого клинического применения у пациентов, находящихся на заместительной почечной терапии, гипофосфатной диеты, фосфат-связывающих препаратов и кальцитриола. В результате удалось добиться более благоприятного течения ренальных остеодистрофий. Однако это не уменьшило остроту проблемы вторичного гиперпаратиреоза и связанных с ним осложнений со стороны сердечно-сосудистой системы.
Современные стандартные подходы к лечению вторичного гиперпаратиреоза при хронических заболеваниях почек
Современная (стандартная) терапия нарушений минерального обмена и связанных с ним осложнений включает диетические рекомендации по ограничению приема фосфатов, прием аналогов витамина D и фосфат-связывающих препаратов. Это в ряде случаев позволяет контролировать показатели фосфорно-кальциевого обмена и уровень паратиреоидного гормона в пределах целевых значений, установленных K/DOQI [22]. Целью терапии вторичного гиперпаратиреоза является снижение четырех лабораторных показателей: уровня паратиреоидного гормона, кальция и фосфора в сыворотке крови, а также фосфорно-кальциевого произведения (табл. 1).
Cтандартная терапия нарушений минерального и костного обмена по данным литературы более чем в половине случаев не позволяет достичь необходимого клинического эффекта, а в некоторых ситуациях даже противопоказана [20].
Так, лишь 47,5% пациентов, находящихся на программном гемодиализе, соблюдают диету, направленную на ограничение фосфатов, при этом уровень фосфора и кальция сыворотки у этой группы больных не имеет достоверных различий по сравнению с пациентами, не соблюдающими диету. Кроме того, содержание фосфора в различных диетах, назначаемых пациентам, варьирует от 550 до 1000 мг/сутки (18–36 ммоль/сутки), что затрудняет контроль количества поступающих с пищей фосфатов [2].
Адекватный гемодиализ также не всегда позволяет справиться с нарушениями минерального обмена. Известно, что современная гемодиализная терапия позволяет удалять лишь лимитированное количество фосфатов: от 20 до 40 ммоль за сеанс, что за неделю составляет 60–120 ммоль [24]. Более того, риск развития тяжелых форм гиперпаратиреоза (и, как следствие,?— относительный риск смерти) у таких больных прямо пропорционален продолжительности нахождения на гемодиализе (смертность в этой группе больных составляет 44% за 4 года) [1]. Эффективным является увеличение диализного клиренса фосфатов с использованием ежедневного дневного или ночного гемодиализа, гемодиафильтрации [11]. Однако такой подход неприменим в широкой клинической практике.
Эффективность терапии активными формами витамина D, например кальцитриолом, также зачастую не оправдывает ожиданий. Применение этой группы препаратов ограничено, во-первых, из-за исходной или развивающейся на фоне лечения резистентности, что требует назначения их в дозах, превышающих физиологические. Во-вторых, имея относительно узкое «терапевтическое окно» и усиливая всасывание кальция и фосфора в желудочно-кишечном тракте, они приводят к гиперкальциемии, усугубляют гиперфосфатемию и увеличивают фосфорно-кальциевое произведение [28]. Предполагаемые механизмы резистентности к лечению активированными аналогами витамина D при хронической почечной недостаточности включают в себя: опосредованные уремией снижение транспорта кальцитриола в паращитовидные железы; снижение образования комплекса кальцитриол–рецепторы к витамину D; снижение содержания функциональных рецепторов к витамину D в ткани паращитовидных желез [12]. Парикальцитол (Земплар) — синтетический селективный активатор рецепторов витамина D.
Подобные парикальцитолу модифицированные аналоги витамина D имеют меньший кальциемический эффект и, соответственно, более широкое терапевтическое окно [12, 19]. Кроме того, они быстрее, чем кальцитриол, подавляют секрецию паратиреоидного гормона и приводят к менее выраженному увеличению концентрации кальция и фосфора в сыворотке [27]. Парикальцитол сохраняет свою способность снижать паратиреоидный гормон у пациентов с гиперфосфатемией или с устойчивостью к терапии кальцитриолом [18].
Традиционное применение кальциевых фосфат-биндеров позволяет в ряде случаев корригировать гиперфосфатемию и гипокальциемию. Однако эта группа препаратов позволяет абсорбировать не более 50% потребляемого фосфора [16]. Кроме того, как любой другой препарат, фосфат-биндеры не лишены побочных эффектов: гиперкальциемия за счет всасывания кальция; связывание в кишечнике железа наряду с фосфатом; желудочно-кишечные расстройства. Необходимо считаться с тем, что на стандартной диете (1–1,2 г/кг/сутки белка) эффективны только высокие дозы карбоната кальция (9–10 г/сутки). Длительное применение таких доз карбоната кальция в 60% случаев осложняется гиперкальциемией. В настоящее время созданы фосфат-биндеры на полимерной основе, не содержащие ни алюминия, ни кальция и не всасывающиеся в кишечнике: севеламера гидрохлорид (RenaGel), севеламера карбонат (Renvela), Genzyme, Ирландия. Основное различие между ними состоит в том, что последний не вызывает метаболического ацидоза и таким образом не способствует прогрессированию костной болезни. Однако опыта применения этой группы препаратов в России пока нет [2].
В качестве крайней меры пациентам с осложненными формами вторичного гиперпаратиреоза применяется оперативное лечение, которое, к сожалению, подчас также оказывается неэффективным [2].
Указанные трудности в лечении нарушений минерального и костного обмена у больных с хроническими болезнями почек способствовали разработке и внедрению в клиническую практику принципиально новой группы препаратов — кальцимиметиков, изменяющих чувствительность рецепторов паращитовидных желез. Цинакалцет (Код АТХ: Н05ВХ01) производится международной биотехнологической компанией AMGEN (США) и зарегистрирован в Северной Америке под торговым названием Сенсипар, а в Европе — Мимпара.
В России препарат появился относительно недавно, поэтому достаточный опыт его практического применения еще не накоплен. За рубежом цинакалцет активно применяется с 2004 года более чем в 34 странах и хорошо зарекомендовал себя не только с клинической, но и с экономической точки зрения, позволяя заметно снизить затраты на лечение тяжелых осложнений хронических заболеваний почек.
Цинакалцет обладает прямым кальцимиметическим действием, непосредственно снижающим уровень паратиреоидного гормона, повышая чувствительность рецептора к внеклеточному кальцию. Снижение уровня паратиреоидного гормона коррелирует с концентрацией цинакалцета в крови. После перорального приема цинакалцета его максимальная концентрация в плазме крови достигается примерно через 2–6 часов, что сопровождается максимальным снижением уровня паратиреоидного гормона в крови. После этого концентрация цинакалцета начинает снижаться, а уровень паратиреоидного гормона повышается в течение 12 часов после введения дозы, в последующем супрессия паратиреоидного гормона остается примерно на одном и том же уровне до конца суточного интервала при режиме дозирования один раз в день. Примерно 80% вводимой дозы цинакалцета выводится почками, 15% — через желудочно-кишечный тракт. Снижение концентрации цинакалцета происходит в два этапа: первоначальный период полувыведения составляет примерно 6 часов, окончательный — от 30 до 40 часов. Стабильное содержание препарата достигается в течение 7 дней с минимальной кумуляцией. После достижения стабильной фазы концентрация кальция в сыворотке крови остается на постоянном уровне в течение всего интервала между приемами препарата. По данным литературы цинакалцет позволяет существенно снизить уровень паратиреоидного гормона уже к концу второй недели лечения.
В качестве иллюстрации вышесказанному приводится следующий клинический пример:
Больная Х., 64 года, с декабря 2005 года находится на лечении программным гемодиализом (в ГВКГ им. Н.?Н.?Бурденко с апреля 2007 года) по поводу терминальной почечной недостаточности в исходе диабетической нефропатии в сочетании с хроническим пиелонефритом. С 1965 года диагностируется алиментарно-конституциональное ожирение 2–3 степени, с 1996 года — сахарный диабет 2-го типа средней тяжести, а затем — тяжелого течения. С 1998 года — ишемическая болезнь сердца: клиника нагрузочной стенокардии отсутствовала, диагноз верифицирован на основании признаков «безболевой ишемии» миокарда и AV-блокады I степени по данным суточного мониторирования электрокардиограммы. Примерно с того же времени повышение уровня артериального давления (АД) до 220 и 140 мм рт. ст., адаптирована к АД 160/100 мм рт. ст. Постоянная четырехкомпонентная гипотензивная терапия в составе: Альбарел 2 мг/сутки, Амловас 20 мг/сутки, Аккупро 20 мг/сутки, Эгилок 100 мг/сутки — позволяла поддерживать целевой уровень АД (не свыше 140/90 мм рт. ст.) до 2005 года. С целью профилактики атеросклеротических осложнений постоянно принимала статины в суточной дозе 10 мг.
С начала 2005 года присоединяются клинико-лабораторные и инструментальные признаки прогрессирования атеросклероза, «озлокачествления» гипертензивного синдрома: в январе 2005 года появляется микроальбуминурия, которая уже в марте сменяется протеинурией до 1,5 г/сутки; несмотря на регулярный прием рекомендованных гипотензивных препаратов развивается лабильность АД. В связи с этим по рекомендации врачей поликлиники при ситуационном повышении АД свыше 160/100 мм рт. ст. (до двух-трех раз в неделю) принимала дополнительно Кордафлекс 40 мг/сутки. По данным визуализирующих методов исследования (эхокардиографии, рентгенографии органов грудной клетки) определяется достаточно быстрое увеличение массы миокарда (исходно 345 г, в последующем 436 г) с появлением признаков диастолической дисфункции первого типа и клинических симптомов хронической сердечной недостаточности на уровне функциональной классификации (ФК) II, метастатической кальцификации мягких тканей, крупных сосудов и створок аортального клапана (атеросклеротический стеноз устья аорты), что в тот период времени трактовалось как следствие особенно тяжелого течения атеросклероза, и в связи с этим увеличивается суточная доза статинов до 20 мг.
В декабре 2005 года на фоне роста азотемии (креатинин сыворотки крови 780 мкмоль/л) в результате обострения пиелонефрита, присоединения пневмонии у больной диагностируется терминальная стадия хронической почечной недостаточности и начинается лечение программным гемодиализом (3 раза в неделю по 4 часа), проведение которого вначале сопровождалось усугублением тяжести гипертензивного синдрома (АД до 240/140 мм рт. ст.). В марте 2006 и феврале 2007 года на фоне плохо поддающейся коррекции артериальной гипертензии переносит повторные острые нарушения мозгового кровообращения в бассейне левой среднемозговой артерии с исходом в правосторонний гемипарез и сенсорно-моторную афазию. В апреле 2007 года для продолжения лечения переводится в ГВКГ им. Н.?Н.?Бурденко.
В этот период у больной сохраняется выраженная артериальная гипертензия (180–200/80–90 мм рт. ст.), резистентная к стандартной ультрафильтрации и вышеуказанной медикаментозной терапии. Проведение гемодиализа с ультрафильтрацией в ежедневном режиме в течение 6 дней в неделю позволило снизить «сухой вес» на 6 кг, что сопровождалось стабилизацией АД на уровне 160/90 мм рт. ст. Концентрация фосфора в сыворотке крови составляла 2,51 ммоль/л, кальция — 2,62 ммоль/л (фосфорно-кальциевое произведение = 6,58 ммоль2/л2), уровень паратиреоидного гормона — 24,8 пг/мл. Учитывая «высокое» фосфорно-кальциевое произведение и нормальное содержание паратиреоидного гормона, медикаментозная терапия не назначалась, больной рекомендовалась гипофосфатная диета и прием карбоната кальция (до 3 г в сутки), однако соблюдение диетических правил оказалось невозможным из-за двигательных расстройств (правосторонняя гемиплегия) и низкого комплаенса (дисциркуляторная энцефалопатия с выраженными когнитивными расстройствами). Это в течение трех месяцев привело к усугублению гиперфосфатемии и гиперкальциемии (3,0 ммоль/л и 2,7 ммоль/л соответственно).
Несмотря на почти полное обездвиживание больной, предрасполагающее к развитию адинамической болезни кости, появляются лабораторные и клинические признаки гиперпаратиреоза: увеличение уровня паратиреоидного гормона до 488 пг/мл, присоединение нестерпимого кожного зуда. Ультразвуковое исследование паращитовидных желез не выявило аденоматозных изменений. Высокий уровень фосфора сделал невозможным назначение активированных аналогов витамина D. Было принято решение об изменении диализной программы с увеличением времени диализа до 15 часов в неделю и добавлением к стандартному гемодиализу еженедельно проводимой гемодиафильтрации (конвекционный клиренс — 21 литр в неделю), использовались также индивидуальные диализаторы с мембраной повышенной сорбционной активности (полиметилметакрилат) с достижением недельного Kt/V до 3,75. Это позволило приостановить прогрессирование клинических и лабораторных признаков гиперпаратиреоза (уровень паратиреоидного гормона к декабрю 2008 года составлял 504 пг/мл), выраженность кожного зуда уменьшилась, однако уровень фосфора и кальция по-прежнему оставался высоким (фосфорно-кальциевое произведение > 8,2 ммоль2/л2). Когда все методы современной терапии нарушений фосфорно-кальциевого и костного обмена были исчерпаны, нами был назначен цинакалцет (декабрь 2008 года) в стартовой дозе 30 мг/сутки.
В дальнейшем контроль показателей фосфорно-кальциевого обмена и уровня паратиреоидного гормона осуществлялся один раз в месяц. С целью оценки возможного влияния цинакалцета на уровень АД, функцию сердечной мышцы ежемесячно выполнялись трансторакальная эхокардиография, суточное мониторирование АД и ЭКГ. Оценка нарушений диастолической функции левого желудочка сердца выполнялась по общепринятым критериям [10, 13, 14]. Ежедневно контролировались масса тела, уровень АД и частота сердечных сокращений (ЧСС) (утром и вечером).
Динамический контроль за указанными параметрами показал, что через 2 недели лечения у больной Х. стойко снизился уровень как систолического, так и диастолического АД (со 160/90 мм рт. ст. до 140/80 мм рт. ст.), уменьшилась ЧСС (с 90 до 78 ударов в минуту), что подтверждалось данными СМАД и ХМЭКГ в январе 2009 года. Снижение АД и урежение ЧСС позволило откорректировать в сторону уменьшения состав гипотензивной терапии: постепенно были полностью отменены Эгилок и Кордафлекс. Уровни паратиреоидного гормона, кальция и фосфора крови оставались прежними. Поскольку в «Инструкции по применению цинакалцета» заявлено, что транзиторное снижение паратиреоидного гормона начинается через 6 часов после приема первой дозы, а стойкое — через 7 дней лечения, отсутствие эффекта через месяц приема препарата у нашей больной было расценено как следствие недостаточной начальной дозы, в связи с чем она была увеличена до 60 мг/сутки (2 таблетки). Однако появление через два дня стойкой тошноты заставило нас вернуться к исходной дозе цинакалцета 30 мг в сутки. Начальное снижение уровня паратиреоидного гормона до 345 пг/мл отмечено лишь в феврале 2009 года — на третьем месяце лечения цинакалцетом в дозе 30 мг/сутки. Еще через месяц начали снижаться уровни кальция, фосфора в крови и фосфорно-кальциевое произведение. Прием цинакалцета в той же дозе в монотонном режиме в течение четырех месяцев позволил практически нормализовать концентрацию кальция и фосфора сыворотки крови (соответственно 2,06 и 2,24 ммоль/л) к июлю 2009 года, а также снизить активность паратиреоидного гормона до 155 пг/мл.
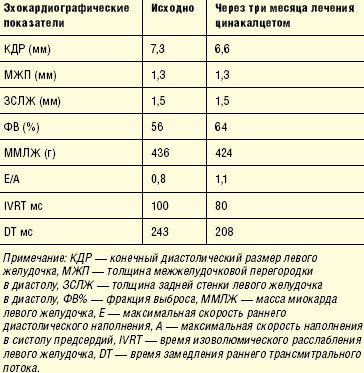
Исходно масса миокарда была повышена до 436 г за счет концентрической гипертрофии и в последующем не изменилась, однако через три месяца лечения цинакалцетом улучшились эхокардиографические показатели функционального состояния сердечной мышцы. Если в начале периода наблюдения имелись все признаки диастолической дисфункции первого типа, характеризующейся нарушением релаксации левого желудочка (аномальная релаксация) и патогенетически связанной с гипертрофией левого желудочка, повышенным уровнем артериального давления и паратиреоидного гормона, то через три месяца лечения цинакалцетом они регрессировали (табл. 2). Незначительно увеличилась фракция изгнания левого желудочка.
Обсуждение
Таким образом, только комплексный подход к лечению нарушений фосфорно-кальциевого обмена и вторичного гиперпаратиреоза с включением в фармакологическую комбинацию кальцимиметиков (цинакалцет) у больной, находящейся на заместительной почечной терапии, позволил поддерживать целевые уровни фосфорно-кальциевого обмена и паратиреоидного гормона, рекомендованные K/DOQI.
В приведенном клиническом случае традиционные подходы к коррекции минерального и костного обмена и связанного с ними вторичного гиперпаратиреоза у больной с терминальной стадией хронической почечной недостаточности, находящейся на гемодиализе, оказались неэффективными, как нам видится, по следующим причинам: невозможность соблюдения гипофосфатемической диеты и приема фосфат-биндеров (карбоната кальция) пациенткой с интеллектуально-мнестическими и двигательными расстройствами; назначение аналогов активированного витамина D (кальцитриол) было ограничено гиперкальциемией.
Дополнение комплексного лечения нарушений минерального обмена цинакалцетом позволило в течение трех месяцев достичь целевых значений минерального обмена и уровня паратиреоидного гормона. Преимуществом цинакалцета в данном случае мы считаем, помимо его очевидной эффективности в отношении гиперфункции паращитовидных желез и минерального обмена, возможность точного дозирования и однократного приема в течение суток.
Более спокойное течение артериальной гипертензии на наш взгляд явилось следствием комплекса причин: сыграли свою роль устранение гипергидратации (исходная масса тела составляла 90 кг, в последующем — 84 кг), успешная коррекции фосфорно-кальциевого обмена и снижение уровня паратиреоидного гормона. Учитывая относительно быстрое достижение нормотензии без увеличения количества и суточной дозировки антигипертензивных препаратов, нельзя исключать непосредственный гипотензивный эффект цинакалцета. Экспериментально были установлены как прямой, так и опосредованный повышенной продукцией NO вазодилятирующий эффект цинакалцета [26], а также его ингибирующее влияние на выработку ренина юкстагломерулярным аппаратом почек [23].
Диспептический синдром в виде тошноты и тяжести в эпигастрии, развившийся на следующий день после увеличения вдвое (до 60 мг) суточной дозы цинакалцета, регрессировал после возвращения к исходной дозе 30 мг так же быстро, как и развился, что не потребовало отмены препарата. Лабораторно-инструментальное обследование (фиброгастродуоденоскопия, ультразвуковое исследование органов брюшной полости, биохимическое тестирование общей и панкератической амилазы в крови и диастазы в моче) не выявило какой-либо патологии со стороны дуоденохоледохопанкреатической зоны, что позволило нам рассматривать развитие данного симптомокомплекса в рамках побочного действия цинакалцета и сделать предварительный вывод о хорошей переносимости препарата. По результатам контролируемых клинических исследований (данные о 656 больных, принимавших цинакалцет, и о 470 больных, принимавших плацебо) наиболее часто встречающимися побочными эффектами были тошнота и рвота, которые отмечались у 31% больных в группе терапии цинакалцетом и у 19% больных в группе плацебо, а также у 27% больных в группе терапии цинакалцетом и у 15% в группе плацебо. Тошнота и рвота были легкой и умеренной степени выраженности и в большинстве случаев носили кратковременный характер. Прекращение терапии в результате развития нежелательных эффектов было вызвано главным образом тошнотой (5%) и рвотой (4%).
Причиной нарушения диастолической функции левого желудочка у больной Х. на наш взгляд являлась концентрическая гипертрофия миокарда, как один из наиболее часто встречающихся вариантов ремоделирования левого желудочка у больных, длительно страдающих артериальной гипертензией и сахарным диабетом. Через три месяца приема цинакалцета стали регрессировать клинические симптомы хронической сердечной недостаточности и эхокардиографические признаки диастолической дисфункции, что более вероятно обусловлено как снижением АД до целевого уровня, так и устранением кардиотоксического действия супрафизиологических коцентраций паратиреоидного гормона. Сыграла свою роль и отмена бета-блокаторов, что стало возможным после назначения цинакалцета, поскольку эта группа препаратов негативно влияет на податливость миокарда. К сожалению, четких рекомендаций и схем терапии больных с диастолической хронической сердечной недостаточностью в настоящее время не существует. Европейское общество кардиологов (ESC) в 1997 г. опубликовало лишь общие направления терапии хронической сердечной недостаточности у больных с диастолической дисфункцией [29]. Поэтому любой положительный опыт лечения нарушений диастолической функции левого желудочка должен тщательно анализироваться.
Кроме того, минимальная эффективная поддерживающая доза цинакалцета 30 мг/сутки, что соответствует 1 упаковке (28 таблеток) на месяц, позволяет говорить о приемлемом фармакоэкономическом профиле препарата.
Таким образом, первый опыт применения цинакалцета при вторичном гиперпаратиреозе у пациентки с терминальной стадией хронической почечной недостаточности, находящейся на программном гемодиализе, оказался более чем положительным. Конечно, для выявления корреляции между снижением уровня паратиреоидного гормона и улучшением течения сердечно-сосудистой патологии необходимо накопить достаточный клинический опыт. Последующие исследования могут подтвердить или опровергнуть данное утверждение.
Источник