Химические свойства водорастворимых витаминов и их анализ
Витамины группы В1
Тиохромная проба
Препараты тиамина легко окисляются в щелочной среде, образуя тиохром, который в УФ-свете обладает характерной синей флюоресценцией, исчезающей при подкислении и вновь возникающей при подщелачивании. Эта реакция известна под названием тиохромной пробы и является специфической для препаратов группы тиамина:
 |
 |
Тиохромную пробу используют для качественного и количественного флуориметрического анализа витамина В1 в лекарственных препаратах, растительном сырье и пищевых продуктах.
Реакция с диазореактивом
Для проведения этой реакции обычно используют диазореактив, полученный из сульфаниловой кислоты.
Тиамин в нейтральной или слабощелочной среде реагирует с солями диазония с образованием окрашенных в красный цвет триазенов:
 |
 |
Реакция применяется для спектрофотометрического количественного анализа тиамина в растворах.
Витамины группы В2
Реакция восстановления
Рибофлавин, принимая два атома водорода, легко восстанавливается до лейкорибофлавина. При этом нарушается сопряженная система связей, что сопровождается исчезновением окраски. Лейкорибофлавин легко окисляется (в организме под действием НАД + ) до рибофлавина. Благодаря этим химическим свойствам коферменты, образующиеся из рибофлавина – ФМН и ФАД, участвуют в окислительно-восстановительных процессах, происходящих в клетке:
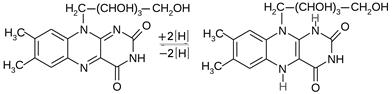 | |
| Рибофлавин (желтого цвета) | Лейкорибофлавин (бесцветный) |
Реакция с солями тяжёлых металлов
Рибофлавин проявляет очень слабые кислые свойства, но образует устойчивые окрашенные соли с ионами тяжелых металлов. При добавлении к водному раствору рибофлавина раствора нитрата серебра или ацетата ртути образуются окрашенные соединения розового или оранжевого цвета, соответственно:
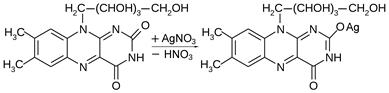 | |
| Рибофлавин (желтого цвета) | Серебряная соль рибофлавина (розового цвета) |
Реакции с солями серебра или ртути используются для качественного и количественного спектрофотометрического анализа рибофлавина.
Витамины группы В6
Реакция с хлоридом железа (III)
Все представители группы витаминов В6 проявляют свойства, характерные для фенолов, в частности они дают общую реакцию подлинности на фенолы с хлорным железом, легко вступают в реакции электрофильного замещения по свободному пара-положению к фенольному гидроксилу. При этом образуется комплексная соль фенолята железа красного цвета:
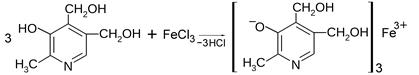 | |
| Пиридоксин | Комплексная соль фенолята железа красного цвета |
Реакция с диазореактивом
Также легко пиридоксин вступает в реакцию азосочетания с солями диазония с образованием окрашенных в красный цвет азокрасителей:
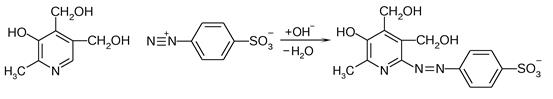 | |
| Пиридоксин | Окрашенное в красный цвет соединение |
Витамины группы РР
Никотиновая кислота проявляет выраженные и кислые, и оснóвные свойства; амид никотиновой кислоты обладает только оснóвными свойствами. Эти различия в свойствах также используются для отличия одного препарата от другого.
Реакция с солями тяжёлых металлов
Никотиновая кислота образует малорастворимые соли с ионами тяжелых металлов. Например, при реакции с сульфатом меди образуется осадок синего цвета:
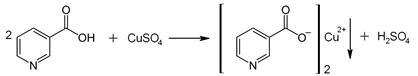 | |
| Пиридоксин | Осадок синего цвета |
В присутствии роданид-ионов образуется комплексная соль зеленого цвета:
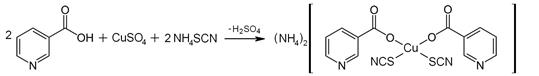 | |
| Пиридоксин | Комплексная соль зеленого цвета |
Витамин С
Аскорбиновая кислота является сильным восстановителем. Она окисляется ионами серебра и меди, йодом, красной кровяной солью, нитратами, кислородом и др. При окислении аскорбиновой кислоты образуется дегидроаскорбиновая кислота:
Источник
Химические реакции с витаминами
Лекарственные вещества принадлежащие к группе витаминов. Витамины алифатического, алициклического и ароматического рядов.
Витамины — это органические вещества, являющиеся биологическими катализаторами химических реакций, протекающих в живой клетке и участвующие в обмене веществ, преимущественно — в составе ферментных систем (энзимовитамины – как правило, водорастворимые вещества). Кроме того, витамины могут выполнять сигнальные функции экзогенных прогормонов и гормонов (гормоновитамины — как правило жирорастворимые в-ва). После открытия и изучения роли эндогенных окислителей и контролирующих их антиоксидантных факторов в организме стало ясно, что большая группа водо- и жирорастворимых витаминов взаимодействуют в организме как антиоксидантная система.
Витамины представляют собой низкомолекулярные органические соединения различной химической структуры, синтезированные, главным образом, растениями, частично микроорганизмами. В отдельных случаях витамины образуются в животных тканях в результате химических преобразований веществ, являющихся их предшественниками (провитаминами). Витамины человек или животные должны получать извне полностью или частично.
Классификация витаминов
Первоначально существовала буквенная классификация витаминов, т.е. по мере открытия отдельных витаминов их обозначали буквами латинского алфавита, а также классифицировали по их биологическому значению.
Так витамин Е — токоферол (деторождение несущий), С — антискорбутный. Была введена также классификация по физическим свойствам, согласно которой все витамины делились по их растворимости на две большие группы: водорастворимые и жирорастворимые.
По действию в организме витамины можно разделить на энзимовитамины
(В1, В2, РР, В6, В12, фолиевая к-та идр.), гормоновитамины (А, D2, D3), витамины – антиоксиданты (А, Е, С, липолиевая к-та)
Наиболее совершенной можно считать химическую классификацию, следуя которой, все витамины можно разделить на следующие группы:
I. Витамины алифатического ряда: кислота аскорбиновая (вит.С), кислота пангамовая (вит. В15), кислота пантотеновая (вит. В3).
I I. Витамины алициклического ряда: ретинолы (вит. группы А), кальциферолы (вит. группы D).
III. Витамины ароматического ряда: витамины группы К.
IV. Витамины гетероциклического ряда: токоферолы (вит. группы Е). биофлавоноиды (вит. группы Р), никотиновая кислота и ее амид (вит. группы РР), пиридоксины (вит. группы В6), тиамины (вит. B1), кислота фолиевая (вит. Вс), рибофлавин (вит. В2), кобаламины (вит. группы В12).
Витамины алифатического ряда
Производные полиокси-?-лактонов ненасыщеных карбоновых кислот
.
Витамин С – аскорбиновая кислота, антискорбутный витамин
Аскорбиновая к-та участвует в регуляции редокс-состояния клеток и является естественным антиоксидантом. Располагая лабильными атомами водорода, несущими неспаренный электрон взаимодействует с активными кислородными радикалами и липоперекисями нейтрализует их с образованием стабильны продуктов.
Аскорбиновая кислота широко распространена в природе. Особенно ею богатый растительный мир: свежие овощи, фрукты, хвоя и др. В промышленности аскорбиновую кислоту получают из D-глюкозы
Кислота аскорбиновая (Acidum ascorbinicum)
Ascorbic acid 
(?- Лактон-2,3-дегидро-L-гулоновой кислоты)
Свойства
Бесцветные кристаллы, изменяющие цвет под действием воздуха и влаги, кислого вкуса. Легко растворим в воде и 96 % спирте, практически нерастворим в эфире.
Аскорбиновая кислота за счет наличия ендиольной группировки проявляет одновременно восстановительные и кислотные свойства. Кислотный характер ее обусловлен подвижностью водорода гидроксила в положении 3; при титровании щелочью аскорбиновая кислота ведет себя как одноосновная кислота (см. количественное определение). Аскорбиновая кислота окисляется в две стадии:
1. Обратимый процесс окисления до дегидроаскорбиновой кислоты (кетонная форма).
2. Необратимый процесс окисления до фурфурола:
Идентификация
1.Определяют УФ- и ИК-спектральные характеристики, рН водного р-ра.
2. Реакция окисления раствором нитрата серебра в азотнокислой среде (выпадает темный осадок металлического серебра) : 
3. При прибавлении к раствору аскорбиновой кислоты по каплям раствора 2,6-дихлорфенолиндофенола синяя окраска последнего исчезает:
При испытании на чистоту определяют удельное оптическое вращение и специфическую примесь щавелевой кислоты (при прибавлении раствора кальция хлорида в сравнении с эталоном). Методом атомно-абсорбционной спектрометрии определяют содержание меди и железа, которое не должно превышать допустимые пределы.
Количественное определение
1.Йодометрически при подкислении разбавленной H2SO4 с индикатором крахмал: 
КIO3 + 5KI + 6HCI>3I2 + 6КСl + ЗН2О
2. Прямое йодатометрическое титрование в кислой среде в присутствии калия йодида (индикатор — крахмал): 
3. Алкалиметрическое титрование:

Применение. В профилактических и лечебных целях при цинге, кровотечениях различной этиологии, инфекционных заболеваниях и интоксикациях, заболеваниях печени и почек.
Хранение. В плотно укупоренном контейнере, в защищенном от света месте.
Производные эфиров глюконовой кислоты
К этой группе витаминов относится пангамовая кислота (вит. В15). В медицине используют ее кальциевую соль.
Содержится пангамовая кислота в рисовых отрубях, дрожжах, крови, печени. По химической структуре пангамовая кислота представляет собой эфир D-глюконовой кислоты и диметиламиноуксусной кислоты.
В 80-е годы прошлого столетия витамин В15 был самым покупаемым аптечным продуктом в Нью-Йорке. Считалось, что она увеличивает скорость окислительных процессов и может служить донором метильных радикалов. Впоследствии оказалось, что клиническая эффективность пангамовой кислоты переоценивалась. Так как у нее не найдено вредного действия , в нашей стране оно не исключена из фармакопеи.
Кальция пангамат (Calcii pangamas) 
Свойства
Белый или с желтоватым оттенком кристаллический порошок с характерным запахом. Гигроскопичен, легко растворим в воде и практически нерастворим в органических растворителях.
Идентификация
1. Наличие характерных максимумов поглощения в его ИК-спектре.
2. Ион кальция определяют по реакции с оксалатом аммония.
3. С катионом Fe3+ — светло-зеленое окрашивание дает остаток глюконовой кислоты.
4. При добавлении к раствору кальция пангамата гидроксида натрия ощущается запах аминов.
5. Для таблеток кальция пангамата — реакция образования окрашенного гидроксамата железа:
Количественное определение
Учитывая, что субстанция, кроме кальция пангамата, содержит 25% кальция глюканата и 6% кальция хлорида, количественно определяют содержание:
- азота – методом ацидиметрии в неводной среде (3.6 -4.2 %);
- кальция – методом комплексонометрии (5.8 – 7.4%);
- хлоридов – методом Фольгарда (не больше 2.2%);
- сумму карбоксильных групп (11 — 15%) – методом ионнообменной хроматографии.
Применение. При различных формах атеросклероза, цироза печени,
алкоголизме и др. заболеваниях. Применяют внутрь в виде таблеток. Пангамат кальция оказывает благоприятное влияние на обмен веществ, улучшает липидный обмен, повышает усвоение кислорода тканями.
Хранение. В хорошо укупоренных склянках, в сухом месте, при комнатной температуре.
Производные ?-аминокислот
К производным ? — аминокислот относится пантотеновая кислота. Богатым источником этой кислоты являются дрожжи, печень и яичный желток.
По химической структуре эта кислота представляет собой амид, образованный ?-аланином и a,?-диокси-. -диметилмасляной (пантоевой) кислотой: 
В медицинской практике применяется кальциевая соль пантотеновой кислоты
Кальция пантотенат (Calcii pantothenas)
Кальциевая соль D-(+)-a,?-диокси-. -диметилбутирил-N -амид- ??-аминопропионовой кислоты
Свойства
Белый мелкокристаллический порошок без запаха, легко растворим в воде, очень мало растворим в органических растворителях. Для кальция пантотената определяют удельное вращение 5% водного раствора.
Идентификация
1. По иону кальция (с оксалатом аммония).
2. Остаток a,?-диокси-. -диметилмасляной кислоты определяют после щелочного гидролиза. Вещество кипятят с раствором гидроксида натрия, после охлаждения подкисляют хлористоводородной кислотой и прибавляют раствор хлорида железа (III) — образуется интенсивно-желтое окрашивание: 
2.Образование комплекса синего цвета с CuS04 в щелочной среде (?-аланин):

Количественное определение. Комплексонометрически по катиону Ca2+ (8,2-8,6%) и по содержанию азота (5,7-6,0%) (метод Къельдаля).
Применение. Для лечения невралгии, экземы, аллергии, полиневрита и других состояний, связанных с нарушением обменных процессов, а также при воспалительных процессах.
Хранение. В сухом месте, в хорошо укупоренных склянках.
Витамины алициклического ряда
Витамины группы А (ретинолы)
В основе молекулы ретинола лежит триметилциклогексановый цикл, связанный с тетраенольной сопряженной цепью, которая оканчивается гидроксильной или альдегидной группой. Ретинол получен из печени рыб в 1909 году. В 1928 г. Эйлер установил существование в некоторых растениях веществ, обладающих провитаминной активностью, т.е. являющихся предшественниками витаминов. Провитаминами витамина А являются a-, ?- и ?-каротины. В медицине применяется ретинола ацетат:
Ретинола ацетат (Retinoli acetas) 
Транс-9,13-диметил-7-( 1,1,5-триметилциклогексен-5-ил-6)-нонатетраен-7,9,11,13-ола-15 ацетат
Свойства
Белые или бледно-желтые кристаллы со слабым запахом. Чрезвычайно неустойчивы по отношению к кислороду воздуха и свету. Практически нераст-ворим в воде, растворим в 95% спирте, хлороформе, эфире и жирных маслах.
Идентификация
Цветная реакция с хлоридом сурьмы (III) (синее окрашивание).
Источник




