Гипофосфатемический витамин d резистентный рахит это
Гипофосфатемический рахит (ГФР)
(Витамин-Д-резистентный рахит; Х-сцепленный доминантный гипофосфатемический рахит; Х-сцепленный рецессивный гипофосфатемический рахит или Х-сцепленный гиперкальциурический нефролитиаз; Аутосомно-доминантный гипофосфатемический рахит; Аутосомно-рецессивный гипофосфатемический рахит 1, 2; Гипофосфатемический рахит с гиперкальциурией; Гипофосфатемический рахит и гиперпаратиреоз; Гипофосфатемический рахит с нефролитиазом/остеопорозом)
Hypophosphatemic rickets; Vitamin D-Resistant Rickets (VDRR); X-Linked Hypophosphatemic rickets (XLHR); X-linked recessive hypophosphatemic rickets (XLR) or X-linked hypercalciuric nephrolithiasis; Autosomal dominant hypophosphatemic rickets (ADHR); Autosomal recessive hypophosphatemic rickets — 1 (ARHR1); Autosomal recessive hypophosphatemic rickets — 2 (ARHR2); Hypophosphatemic rickets with hypercalciuria (HHRH); Hypophosphatemic rickets and hyperparathyroidism; Hypophosphatemic nephrolithiasis/osteoporosis-1 (NPHLOP1).
MIM # 307800, #300554, #193100, #241520, # 241530, #613312, #612089, #612286
Генетика: мутации различных генов: фосфатрегулирующего гена с гомологией к эндопептидазам на Х-хромосоме (PHEX); потенциал-зависимого канала хлоридов 5 (CLCN5); фактора роста фибробластов 23 (FGF23); дентин-матричного протеина 1 (DMP1); эктонуклеотид пирофосфатаза/фосфодиэстераза 1 (ENPP1); натрий-фосфорного котранспортера тип 2 (SLC34A3; Npt2c); клото (Klotho, KL); натрий-фосфорного транспортера тип 2 (SLC34A1, Npt2)
Гены картированы на Xp22.11, Хp.11.23-p11.22-хромосоме, 12p13.32, 4q22.1, 6q23.2, 9q34.3, 13q13.1, 5q35.3, соответственно.
Тип наследования: Х-сцепленный доминантный, Х-сцепленный рецессивный, аутосомно-доминантный, аутосомно-рецессивный, соответственно.
Эпидемиология: относятся к редким наследственным заболеваниям. Х-сцепленный доминантный гипофосфатемический рахит встречается с частотой 1:20 000 живых новорожденных. Частота остальных форм неизвестна.
Патогенез
За счет поломки генов нарушается реабсорбция фосфора (т.е. обратное всасывание фосфора из первичной мочи в кровь) в проксимальных почечных канальцах, что приводит к потере фосфора из организма. Недостаток фосфора является причиной нарушения минерализации костей скелета и зубов, что приводит к развитию рахита. При данном заболевании снижается активность 1альфа-гидроксилазы (CYP27b1) в почках, поэтому нарушается образование из неактивной формы витамина Д (т.е.холекальциферола) той формы, которая является биологически активной, т.е. кальцитриола (1,25(ОН)2D), в связи с чем назначение препаратов нативного витамина Д (холекальциферол, рыбий жир, аквадетрим, вигантол) является неэффективным.
При некоторых формах наряду с потерей фосфора нарушается регуляция синтеза паратгормона и 1,25(ОН)- витамина Д, что может приводить к развитию гиперпаратиреоза, гиперкальциурия с формированием нефрокальциноза.
Клинические проявления: как правило манифестация заболевания отмечается на 1-2 году жизни ребенка, при некоторых формах начало клинических проявлений отмечается в более позднем возрасте (5-6 лет). Корреляции между генотипом и фенотипом не отмечено. В одной семье тяжесть клинических проявлений между пострадавшими родственниками может быть различной.
Основными клиническими признаками ГФР являются:
- рахитические деформации грудной клетки, гипертрофия лобных бугров на первом году жизни;
- прогрессирующие деформации ног с момента начала ходьбы;
- «переваливающаяся» походка;
- мышечная слабость;
- задержка роста;
- боль в костях;
- позднее прорезывание зубов или частый кариес и абсцессы.
На первом году жизни у ребенка могут отмечаться характерные признаки рахита: гипотония, гипертрофия лобных бугров, рахитические «браслетки» на лучезапястных суставах, «четки» на ребрах, с началом самостоятельной опоры на ноги или самостоятельной ходьбы появляется варусная (или О-образная) деформация ног. Дети начинаются ходить широко расставив ноги, походка переваливающаяся (по типу «утиной»), при этом быстро устают. В последующем может сформироваться вальгусная (или Х-образная) деформация ног.
У некоторых пациентов в раннем детском возрасте может сформироваться краниостеноз. Прорезывание зубов у детей запаздывает, со 2-3 года жизни отмечается истончение эмали, частый кариес, часто — спонтанные абсцессы зубов по причине формирования прикорневых кист.
На 2-3 году отмечается замедление динамики роста, дети отстают от сверстников в физическом развитии, в последующем отставание в росте наростает, что может быть связано с прогрессирующими деформациями ног. Деформации ног ведут к диспропорциональному телосложению за счет укорочения нижнего сегмента.
На фоне назначения препаратов нативной формы витамина Д (холекальциферол, рыбий жир, вигантол, аквадетрим) даже в очень высоких дозах эффекта не наблюдается. Проведение коррегирующих остеотомий на костях ног в допубертатном периоде (до 13-14 лет), как правило, практически в 100% случаев характеризуется рецидивом деформаций или усугублением искривлений ног.
В взрослом возрасте у пациентов имеется значительно выраженный болевой синдром в области коленных суставов и их тугоподвижность (артоз), нефрокальциноз, кальцификация связок. При минимальных травмах возможны переломы костей ног, рук на фоне остеопороза. После 18 лет отмечаются частые абсцессы зубов, возможно до полного отсутствия собственных зубов. Кроме того по причине кальцификации связок в среднем у пациентов может отмечаться снижение слуха.
Диагностика: при всех формах ГФР в крови определяется низкий уровень фосфора, как правило, в период активного роста ребенка в крови резко повышена активность щелочной фосфатазы, при нормальном уровне кальция. В моче при всех формах ГФР определяется гиперфосфатурия, при этом следует помнить, что определение гиперфосфатурии проводится по специальным формулам для расчета тубулярной реабсорбции фосфатов (TRP, %) и пересчет данного показателя к скорости клубочковой фильтрации (TmP/GFR, ммоль/л). Определение фосфора в разовой или суточной порции мочи является неинформативным. Концентрация 1,25(ОН)2D в сыворотке и степень кальциурии варьируют и зависят от молекулярной основы заболевания. Уровень паратиреоидного гормона в крови может быть нормальным или умеренно повышен.
На первом году жизни у ребенка с ГФР уровень фосфора крови может быть низконормальным, поэтому обязательно необходимо производить определение тубулярной реабсорбции фосфатов в моче. Важно, сравнивать получаемые показатели фосфора крови пациента с референсными значениями с учетом возраста и пола, в раннем детском возрасте (до 3 лет) уровень фосфора в крови значительно выше, чем в подростковом.
При проведении рентгенологического исследования длинных трубчатых костей (кости предплечий, бедренные кости, кости голеней) отмечаются характерные рахитические изменения структуры: бокаловидные утолщения зон метафизов, размытость, «изъеденность» структуры метафизов. При рентгенографии грудной клетки можно отметить наличие утолщений (рахитические «четки») в зоне соединения костной и хрящевой частей ребер.
В более взрослом возрасте при проведении обзорного рентгенологического снимка челюстей возможно обнаружить наличие кистозных полостей в области корней зубов.
Молекулярно-генетическая диагностика проводится в лаборатории наследственных эндокринопатий НИИ Детской эндокринологии ФГБУ ЭНЦ (http://www.endocrincentr.ru/)
Лечение
В настоящее время в мире используются препараты фосфорного буфера в сочетании с активными формами витамина Д (альфакальцидолом или кальцитриолом). Данная схема терапии применяется у пациентов в период активного роста (до 18 лет). Следует помнить, что при данном заболевании прием препаратов фосфора должен быть распределен на 5-6 раз в сутки по причине быстрого выведения фосфора из организма. Дозы подбираются в зависимости от веса пациента и переносимости препарата. Эффективность лечения оценивается по отсутствию прогрессии деформаций ног, улучшению физической активности (уменьшению мышечной слабости), улучшению динамики роста. Нормализация уровня фосфора в крови не является целью лечения и, наоборот, достижение нормального показателя фосфора крови говорит о передозировке препаратами. На фоне проводимой терапии необходимо регулярное наблюдение лечащего доктора, проводить контроль уровня паратгормона крови, экскреции кальция в моче и УЗИ почек, с целью избежать побочных эффектов от терапии. Возможные побочные эффекты: ранние- жидкий стул, тошнота; поздние- торичный гиперпаратиреоз, гиперкальциурия, нефрокальциноз.
Пациентам, достигшим конечного роста (после 18 лет), рекомендуется назначать препараты фосфора по следующим показаниям: 1. Выраженная мышечная слабость и боли в костях,которые ограничивают активные движения. 2. При проведении оперативных вмешательств на костях (коррегирующие остеотомии) с целью улучшения регенерации костной ткани. 3. При выраженном остеопорозе.
Проведение коррегирующих остеотомий возможно при достижении 15-16 лет на закрытых зонах роста. При выраженных деформациях в раннем детском возрасте применяется методика временного эпифизиодеза (блокирование зон роста) с использованием 8-образных пластин.
У некоторых пациентов с выраженным отставанием в росте возможно применение рекомбинантного гормона роста (рГР) с целью улучшения ростового прогноза.
Всем пациентам показано каждые 2-3 месяца проводить курсы лечебно-профилактической физкультуры, лечебного массажа. С целью укрепления мышц и предотвращения артрозов крупных суставов (локтевых, коленных) рекомендуются ежедневные физические упражнения (утренняя или вечерняя зарядка), заниматься плаванием, ездой на велосипеде.
При выраженном болевом синдроме в костях- симптоматическая терапия (анальгетики, НПВС).
При сформировавшихся артрозов суставов- проведение пластики суставов.
С целью предотвращения полной потери зубов полость рта должна осматриваться стоматологом не реже чем раз в 3 месяца. В детском возрасте возможно проведение фторирования зубов или покрытие специальным гелем. При посещении стоматолога следует уведомить врача о возможно быстром повреждении эмали при проведении каких-либо процедур.
Прогноз
Прогноз по заболеванию благоприятный.
Источник
Гипофосфатемический рахит
Гипофосфатемический рахит (ГФР), или витамин-D-резистентный рахит (ВДРР) – гетерогенная группа наследственных заболеваний, характеризующаяся развитием рахитических изменений костной ткани вследствие повышенного выведения фосфора из организма.
Известно, что фосфор с кальцием принимают участие в минерализации костной ткани, обуславливая прочность костей. Кроме того, фосфор необходим для синтеза молекул АТФ, построения мембран клеток организма. При ГФР организм ежедневно теряет фосфор в связи с нарушением его обратного всасывания в почках, что и приводит к развитию картины рахита.
На настоящее время известно, что развитие наследственного ГФР обусловлено дефектами в различных генах, наиболее часто у пациентов выявляются мутации в гене PHEX. Ген PHEX локализован на Х-хромосоме и принимает участие в регуляции реабсорбции фосфора в почках. При наличии мутаций данного гена у матери риск рождения ребенка с аналогичным заболеванием составляет 50% независимо от пола, тогда как если болен отец – все мальчики будут здоровы, а девочки будут иметь ГФР.
По данным зарубежных исследований, распространенность Х-сцепленного доминантного ГФР в результате дефектов гена PHEX составляет 1:20 000 новорожденных. Другие формы ГФР (аутосомно-доминантный; аутосомно-рецессивный; Х-сцепленный рецессивный) встречаются редко и распространенность их не известна.
В клинической картине заболевания у детей выделяют следующие ведущие синдромы:
- деформации скелета (варусная или вальгусная деформация ног, при этом прогрессия деформаций связана с моментом начала самостоятельной ходьбы; рахитические «браслетки», «четки»; долихоцефалическая форма черепа за счет гипертофии лобных бугров);
- мышечная гипотония (быстрая утомляемости при ходьбе; дети менее активны, чем их сверстники);
- задержка физического развития (задержка роста нарастает к 3–5 годам и часто связана с усугублением деформаций ног);
- диспропорциональное телосложение за счет укорочения нижнего сегмента;
- патология зубов (позднее прорезывание молочных и постоянных зубов или их раннее выпадение из-за воспалительных изменений (пульпит, кариес, периодонтит, прикорневые абсцессы).
В связи с неспецифическими проявления ГФР, которые сходны с алиментарным рахитом, часто диагностика ГФР запаздывает, и пациенты длительное время могут принимать в высоких дозах препараты холекальциферола (нативная, не гидроксилированная форма витамина D) без эффекта.
Биохимические и гормональные маркеры ГФР:
- гипофосфатемия (нормы фосфора в крови в детском возрасте значительно выше (1,45–1,87 ммоль/л), чем во взрослом (0,87–1,45 ммоль/л));
- гиперфосфатурия (необходимо проводить расчет тубулярной реабсорбции фосфора (TRP [%], TmP/GFR [ммоль/л]) по специализированным формулам);
- повышение активности щелочной фосфатазы (ЩФ);
- нормальный или умеренно повышенный уровень паратгормона (ПТГ);
- нормальный уровень кальция в крови.
Рентгенологические признаки рахита:
- расширение и неоднородность зон метафизов трубчатых костей (кости предплечий, кости нижних конечностей), бокаловидные вдавления метафизов, «изъеденные» мыщелки.
Общепринятой на сегодняшний день схемой лечения пациентов с наследственными формами ГФР является назначение солей фосфора в сочетании с альфакальцидолом или кальцитриолом. Цель данной терапии заключается в предотвращении прогрессии деформаций костей, улучшении динамики роста и состояния зубов, а также в уменьшении проявления мышечной гипотонии.
Необходимо отметить, что лечение ГФР должно проводиться под регулярным наблюдением врача. На фоне терапии возможно развитие побочных эффектов, а именно: диспепсия (тошнота, рвота, диарея), нефрокальциноз и вторичный гиперпаратиреоз.
Клинический случай
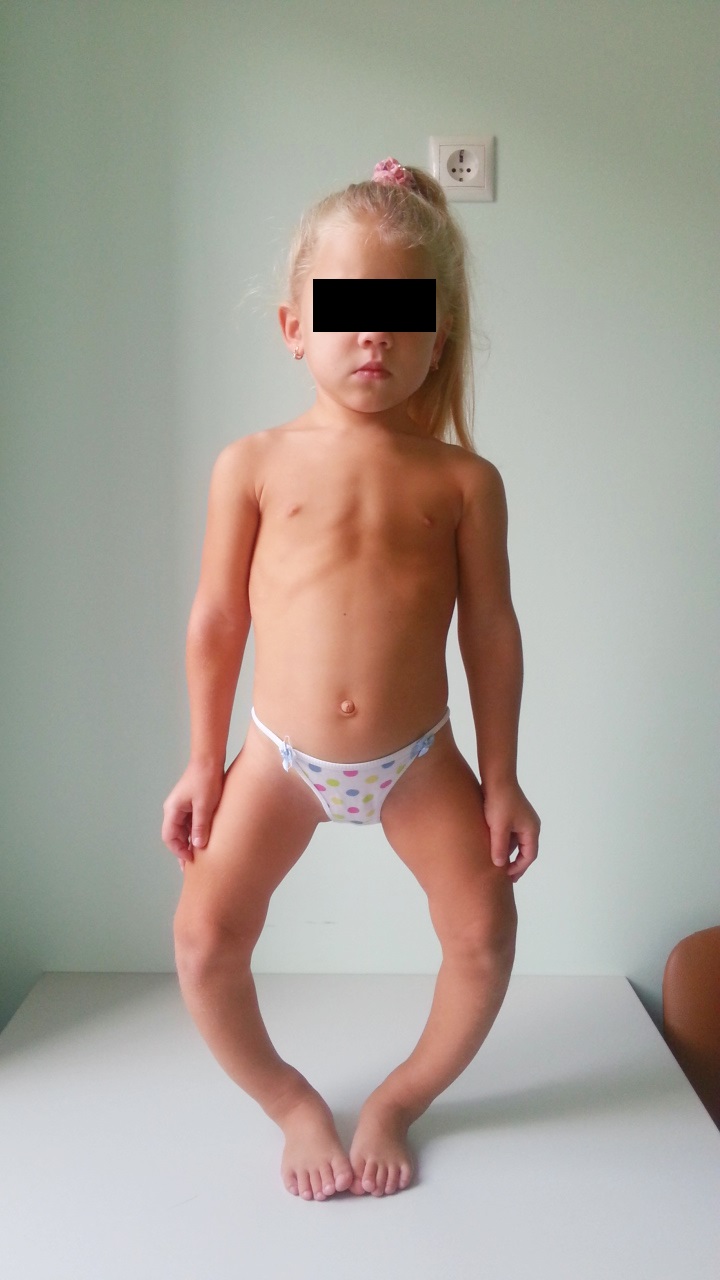
Девочка была рождена от нормально протекавшей беременности, в срок с нормальными показателями веса и роста (50 см, 3100 г, оценка состояния при рождении по шкале Апгар 8–9 баллов). На первом году жизни у ребенка отмечалась диффузная мышечная гипотония. Деформаций скелета у родителей и близких родственников пациента не было.
В возрасте 1,5 года ребенок начал самостоятельно ходить, отмечалась «утиная» походка. К 2 годам сформировалась варусная деформация ног, которая в последующем прогрессировала. При обследовании по месту жительства было выявлено повышение активности ЩФ до 1950 Ед/л (норма: 186–352), уровень кальция и фосфора в крови не исследовались. По данным рентгенологического исследования было выявлено расширение и неоднородность зон метафизов обеих локтевых костей. Ребенку был установлен диагноз «алиментарный рахит» и назначен витамин D3. На фоне проводимой терапии деформации ног прогрессировали, с 3 лет отметилась задержка роста. Ребенок находился под наблюдением педиатра, ортопеда и генетика с диагнозом «Алиментарный рахит. Хондродисплазия (?)».
С 3,5 лет у ребенка появился частый кариес, в 3,8 лет выпало два молочных зуба по причине прикорневых абсцессов. При длительной ходьбе девочка предъявляла жалобы на боль в ногах, ребенок не мог длительно ходить и бегать, предпочитая малоподвижные игры.
Учитывая отсутствие положительного результата на фоне терапии препаратами витамина D3 и усугубление рахитических деформаций скелета, пациенту было рекомендовано обследование в Эндокринологическом научном центре.
По результатам проведенного обследования были выявлены гипофосфатемия (фосфор сыворотки 0,67 ммоль/л), гиперфосфатурия (TRP = 71%, TmP/GFR = 0,47 ммоль/л), вторичный гиперпаратиреоз (ПТГ 83 пг/мл), нормокальциемия (кальций общий 2,53 ммоль/л, кальций ионизированный 1,17 ммоль/л). По данным рентгенографии определялись характерные признаки рахита: размытость зон метафизов локтевых и лучевых костей с бокаловидными вдавлениями. Аналогичная рентгенологическая картина была выявлена при исследовании костей нижних конечностей.
По совокупности полученных результатов, а также анамнеза заболевания ребенку был установлен диагноз «гипофосфатемический рахит». Молекулярно-генетическое исследование выявило наличие мутации c.58C>T p.R20X гена PHEX, на основании чего окончательный диагноз звучал как «Х-сцепленный доминантный гипофосфатемический рахит».
Ребенку была назначена терапия препаратом фосфорного буфера (стартовая доза из расчета 40 мг/кг/сутки по элементарному фосфору) в сочетании с альфакальцидолом (стартовая доза 0,5 мкг/сутки).
Дискутабельным остается вопрос об оперативной коррекции деформации ног при ГФР, а именно: возраст и вид вмешательства.
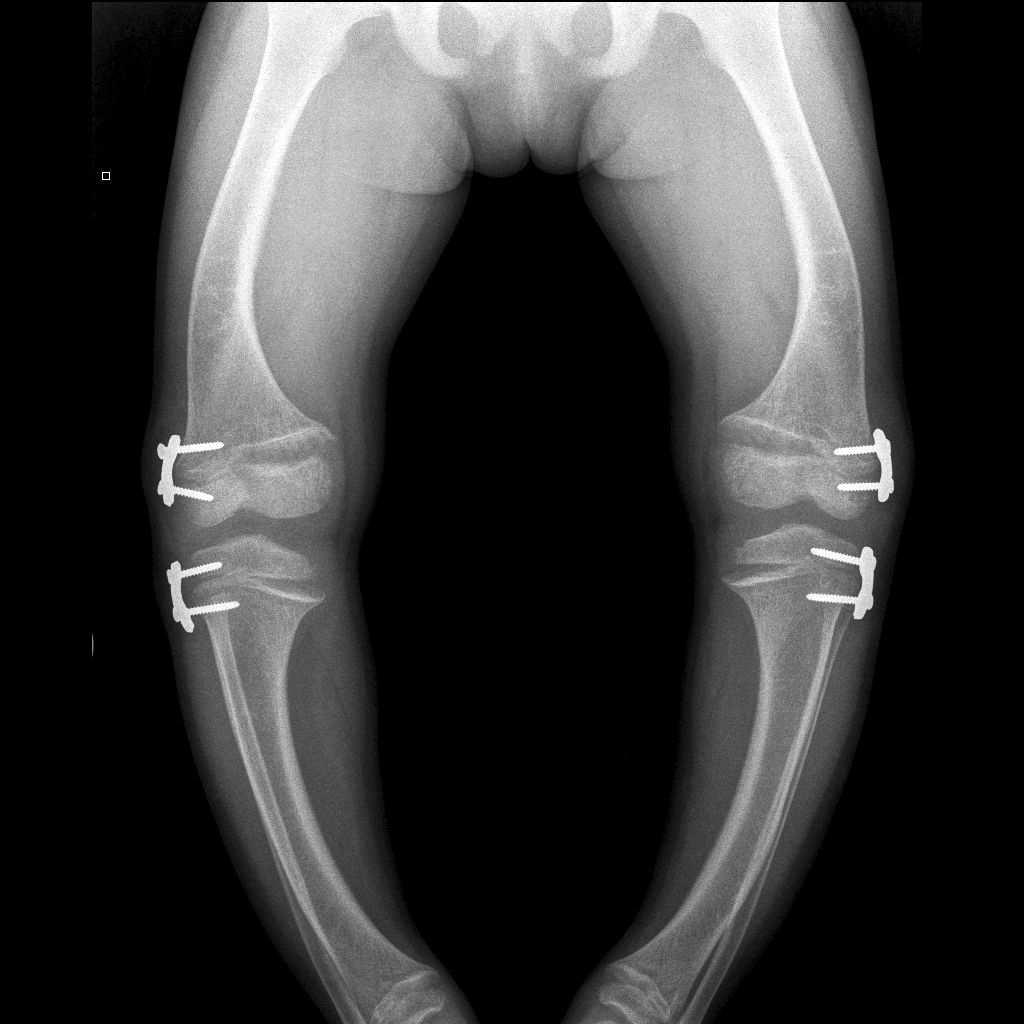
Известно, что проведение коррегирующих остеотомий в раннем детском возрасте на открытых зонах роста имеет до 100% риск редидива деформаций. Однако, учитывая выраженную деформацию ног у нашего пациента, совместно с детскими травматологами-ортопедами было принято решение о проведении временного эпифизиодеза 8-образными пластинами на зоны роста костей нижних конечностей (рис. 2). Данный способ коррекции является менее травматичным, применим на открытых зонах роста и рекомендован к использованию по результатам большинства зарубежных исследований.
На фоне терапии препаратами фосфора и альфакальцидола у пациента увеличилась физическая активность, скорость роста составляла в среднем 5,3 см в год, что соответствовало возрастной норме. Спустя 8 месяцев от проведения временного эпифизиодеза отмечается умеренно выраженная положительная динамика – деформации ног незначительно уменьшились, однако окончательный вывод об эффективности проводимой терапии можно будет сделать через 5–7 лет.
Заключение
В настоящее время на основании новых данных о причинах развития рахита являются целесообразными и обязательными исследования показателей фосфорно-кальциевого обмена у всех пациентов с рахитическими деформациями скелета на предмет возможного выявления наследственных форм рахита. Всем пациентам с клинической картиной рахита показано определение индексов тубулярной реабсорбции фосфатов, учитывая их высокую информативность в выявлении гиперфосфатурии, тогда как рутинное определение фосфора в моче имеет низкую диагностическую ценность.
Следует помнить, что целью консервативной терапии при ГФР препаратами фосфора является не нормализация уровня фосфора в крови, а улучшение структуры костной ткани и динамики роста пациента. При попытке достижения нормальных значений фосфора в крови на фоне лечения высок риск развития нефрокальциноза и вторичного гиперпаратиреоза.
В целях определения причины развития ГФР целесообразно проведение генетической диагностики, и в первую очередь поиск мутаций в гене PHEX. Кроме того, генетическая верификация диагноза дает возможность проведения в дальнейшем пренатальной диагностики данного заболевания у будущих детей в этой семье.
Важным аспектом ведения пациентов является применение физиотерапевтических процедур (ЛФК, массаж, плавание) и наблюдение стоматолога.
Регулярность динамического наблюдения пациентов с ГФР составляет раз в 3–6 месяцев с обязательным контролем показателей крови (ЩФ, кальций, паратгормон), мочи (индекс кальций/креатинин) и УЗИ почек.
Источник