Гемоглобин
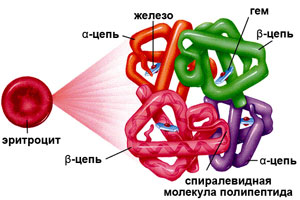
Строение гемоглобина
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
| Тип гемоглобина | Процент содержания у взрослого человека |
| HbA — взрослый гемоглобин | 98% |
| HbA2 – взрослый гемоглобин минорный | Около 2% |
| HbFi – фетальный гемоглобин | 0,5-1% |
| Эмбриональный гемоглобин | нет |
| HbA1C – гликированный гемоглобин |
Аномальных гемоглобинов более 300, их называют по месту открытия.
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
- Оксигемоглобин – соединение гемоглобина с кислородом. Оксигемоглобин преобладает в артериальной крови, идущей от легких к тканям. Из-за содержания оксигемоглобина артериальная кровь имеет алый цвет.
- Восстановленный гемоглобин или дезоксигемоглобин (HbH) — гемоглобин, отдавший кислород тканям
- Карбоксигемоглобин – соединение гемоглобина с углекислым газом. Находится в венозной крови и придает ей темный вишневый цвет.
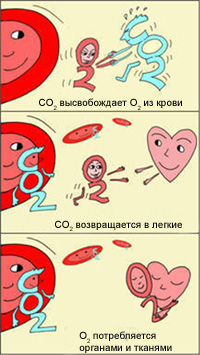
Как же это происходит? Почему в легких гемоглобин забирает, а в тканях отдает кислород?
Эффект был описан датским физиологом Христианом Бором http://en.wikipedia.org/wiki/Christian_Bohr (отцом знаменитого физика Нильса Бора).
Христиан Бор заявил, что при большей кислотности (более низкое значение рН, например, в тканях) гемоглобин будет меньше связываться с кислородом, что позволит его отдать.
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.
Эффект Бора имеет громадное значение для функционирования организма. Ведь если клетки интенсивно работают, выделяют больше СО2, эритроциты могут снабдить их большим количеством кислорода, не допуская кислородного «голодания». Следовательно, эти клетки могут и дальше работать в высоком темпе.

В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.
Заболевания, связанные с изменением количества или структуры гемоглобина
- Повышение уровня гемоглобина наблюдается при эритроцитозах, обезвоживании.
- Снижение уровня гемоглобина наблюдается при различных анемиях.
- При отравлении угарным газом образуется карбгемоглобин (не путайте с карбоксигемоглобином!), который не может присоединять кислород.
- Под действием некоторых веществ образуется метгемоглобин.
- Изменение структуры гемоглобина называется гемоглобинопатией. Самые известные и частые заболевания этой группы – серповидно-клеточная анемия, бета-талассемия, персистенция фетального гемоглобина. См.гемоглобинопатии на сайте Всемирной организации здравоохранения http://www.who.int/mediacentre/factsheets/fs308/ru/index.html
Знаете ли Вы?
- У беспозвоночных животных гемоглобин растворен в плазме крови.
- В сутки из легких в ткани переносится около 600 литров кислорода!
- Красный цвет крови придает гемоглобин, входящий в состав эритроцитов. У некоторых червей вместо гемоглобина хлорокруорин и кровь зеленая. А у каракатиц, скорпионов и пауков голубая, так как вместо гемоглобина – содержащий медь гемоцианин.

Источник
Проблемы с гликированным гемоглобином: продукты и необходимые изменения режима
Проблемы с гликированным гемоглобином: продукты и необходимые изменения режима
Глюкоза натощак — это маркер, который подвержен влиянию самых разнообразных факторов. Сейчас она может быть высокой, через пару часов снизится. Гликированный гемоглобин — куда более интересный и стабильный показатель. Он показывает относительно долгосрочную картину — что происходило с сахаром в крови в течение приблизительно 3 месяцев.
Что делать, чтобы постепенно привести в норму этот параметр?
1. Во-первых, вместе с врачом ищите первопричину. Возможно, какое-то хроническое заболевание запустило этот процесс гликирования. Обязательно разберитесь.
2. Худейте. Опыт и исследования говорят о том, что это лучший способ нормализовать гликированный гемоглобин. Конечно же, для тех, у кого вообще есть лишний вес.
Как только ткани начинают активно использовать глюкозу, она перестает гонять по крови так долго и в таком количестве, повреждая ее частицы. Добивайтесь того, чтобы все питательные вещества шли не в жир, а в ход. Утилизируйте сахар. Внизу будут все ссылки на исследования, ибо это важно.
3. Тренировки. Вообще, лучшее, что может для себя сделать как диабетик, так и здоровый человек, который хочет нормализовать уровень сахара — тренироваться. Умеренно, без стресса и сверхдостижений.
Ясное дело, что тренировки для людей с преддиабетом или диабетом не будут такими суровыми, как для обычных людей. 30 минут силовых 3 раза в неделю — этого достаточно! Потом повысите, если захотите.
Вы знаете, это практика. Моя личная практика и практика коллег (я всегда собираю обратную связь): сахар снижается приблизительно за год у тех, кто соблюдает дефицит калорий и тренируется под присмотром. Подумайте об этом.
Вам не нужно бояться того, что вы будете как-то не так выглядеть среди «качков». Вы спасаете сейчас буквально свою жизнь. Обратите внимание именно на упражнения с отягощениями: их отсутствие превращает вас в метаболического нездорового человека.
Или же — для экстремалов — отлично подходят короткие сессии по 10 минут с очень высокой нагрузкой (работа на пределе возможностей в течение пары минут, потом отдых).
Поставьте задачу: более 150 минут тренировок в неделю суммарно! Это не сверхусилия, поверьте.
4. Бросайте курить. Если кто-то все еще не бросил. Курение всегда чуть ухудшает показатели как гликированного гемоглобина, так и глюкозы натощак. Курящий диабетик радует своего врача еще меньше, чем некурящий.
5. Спите и восстанавливайтесь. Ниже приведу исследования, которые говорят о том, что увеличение продолжительности сна всего на час может дать вам выигрыш на целую единицу гликированного гемоглобина.
А еще позднее время отхода ко сну связано с худшей ситуацией с сахаром в крови.
При проблемах с гликированным гемоглобином спать надо уж точно более 6 часов. И работать с тревожностью — прерывистый сон тоже очень плохо влияет.
6. Снимайте стресс. Работа со стрессом — это первая рекомендация, которую я бы дала тем, кто хочет наладить ситуацию с сахаром. Поступающий извне сахар — это очень плохо, но нарушение его регуляции является внутренней проблемой. Хронически высокий кортизол очень опасен для тех, кто находится в группе риска.
Работайте над эмоциональным здоровьем, сломать его очень просто, а чинить вы потом будете все вытекающие, а не основную проблему — не до нее будет.
7. Следите за гигиеной полости рта. Надо очень тщательно и регулярно чистить зубы, но главное — решить проблемы с ротовой полостью. Местные воспаления, согласно исследованиям, тоже способствуют повышению гликированного гемоглобина.
8. Уберите весь сахар и переработанные углеводы. Все, абсолютно все, что вызывает скачки сахара, должно быть устранено. Я бы сюда добавила еще срывы и любовь к большим разнообразным порциям.
Упрощайте — это жизненно важно. Низкоуглеводная диета в этом здорово помогает: еда, богатая белками и нищая на углеводы.
9. Клетчатка. Она помогает контролировать уровень сахара в крови. Ягоды, овощи, орехи, зелень, авокадо, отруби.
Как ни странно, отдельно отмечают овсянку (или отруби из нее) — она помогает снизить гликированный гемоглобин. Основное действующее вещество — бета-глюканы из цельного овса. Экстраты так не работают, только сам овес и отруби.
10. Средиземноморская диета или палео. Лучшее, что вы можете выбрать для хорошего контроля сахара в крови и мягкого дефицита калорий без голода и мучений.
Рыба, нежирный сыр (фета), свежие овощи, оливковое масло, орехи отлично снижают уровень гликированного гемоглобина.
Палео — это для тех, кто предпочитает мясо и яйца, дополняя их овощами, ягодами, фруктами, орехами. Тоже получается прекрасный рацион.
11. Вода. Регулярное потребление чистой воды положительно влияет на ситуацию с гликированным гемоглобином.
12. Кисломолочные продукты с пробиотиками. Было несколько исследований на эту тему, определенные штаммы (l.fermentum) снижают гликированный гемоглобин.
13. Горький шоколад. Примерно 25 граммов в день тоже благотворно сказываются на ситуации с гликированным гемоглобином. Но контроль необходим.
Как вы понимаете, организм не любит вечно сходить с ума и выдавать дикие показатели. Если вы хотя бы на год уйдете от вредной еды, начнете высыпаться, введете посильные тренировки и научитесь есть не до полного растяжения желудка, результаты вам очень понравятся.
А чистая вода, квадратик шоколада в качестве десерта, зеленый чай, чеснок, кисломолочные продукты будут дополнительным подспорьем.
Источник
ГЕМОГЛОБИН
ГЕМОГЛОБИН, Hb (haemoglobinum; греч. haima кровь + лат. globus шарик),— гемопротеид, сложный белок, относящийся к гемсодержащим хромопротеидам; осуществляет перенос кислорода от легких к тканям и участвует в переносе углекислого газа от тканей в органы дыхания. Гемоглобин содержится в эритроцитах всех позвоночных и некоторых беспозвоночных животных (черви, моллюски, членистоногие, иглокожие), а также в корневых клубеньках некоторых бобовых растений. Мол. вес (масса) Гемоглобина эритроцитов человека равен 64 458; в одном эритроците находится ок. 400 млн. молекул Гемоглобина. В воде Гемоглобин хорошо растворим, нерастворим в спирте, хлороформе, эфире, хорошо кристаллизуется (форма кристаллов Гемоглобина различных животных неодинакова).
В состав Гемоглобина входит простой белок— глобин и железосодержащая простетическая (небелковая) группа — гем (96 и 4% от массы молекулы соответственно). При pH ниже 2,0 происходит расщепление молекулы Гемоглобина на гем и глобин.
Содержание
Гем (C34H32O4N4) представляет собой железопротопорфирин— комплексное соединение протопорфирина IX с двухвалентным железом. Железо находится в центре протопорфиринового ядра и связано с четырьмя атомами азота пиррольных ядер (рис. 1): две связи координационные и две связи с замещением водорода.
Поскольку координационное число железа равно 6, две валентности остаются неиспользованными, одна из них реализуется при связывании гема с глобином, а ко второй присоединяется кислород или другие лиганды — CO, F + , азиды, вода (рис. 2) и т. д.
Комплекс протопорфина IX с Fe 3+ называют гематином. Солянокислая соль гематина (хлоргемин, гемин) легко выделяется в . кристаллическом виде (так наз. кристаллы Тейхманна). Гем обладает способностью образовывать комплексные соединения с азотистыми соединениями (аммиаком, пиридином, гидразином, аминами, аминокислотами, белками и т. д.), превращаясь при этом в гемохромогены (см.). Поскольку у всех видов животных гем одинаков, то различия в свойствах гемоглобинов обусловлены особенностями строения белковой части молекулы Г. — глобина.
Глобин
Глобин — белок типа альбуминов, содержит в своей молекуле четыре полипептидные цепи: две альфа-цепи (в каждую из которых входит по 141 аминокислотному остатку) и две бета-цепи, содержащие по 146 остатков аминокислот. Т. о., белковый компонент молекулы Г. построен из 574 остатков различных аминокислот. Первичная структура, т. е. генетически обусловленная последовательность расположения аминокислот в полипептидных цепях глобина человека и ряда животных, полностью изучена. Отличительной особенностью глобина человека является отсутствие в его составе аминокислот изо лейцина и цистина. N-концевыми остатками в альфа- и бета-цепях являются остатки валина. C-концевые остатки альфа-цепей представлены остатками аргинина, а бета-цепей — гистидина. Предпоследнее положение в каждой из цепей занимают остатки тирозина.
Рентгеноструктурный анализ кристаллов Г. позволил выявить основные особенности пространственной структуры его молекулы [Перутц (М. Perutz)]. Оказалось, что альфа- и бета-цепи содержат спиральные сегменты различной длины, которые построены по принципу альфа-спиралей (вторичная структура); альфа-цепь имеет 7, а бета-цепь — 8 спиральных сегментов, соединенных неспиральными участками. Спиральные сегменты, начиная с N-конца, обозначаются буквами латинского алфавита (А, В, С, D, E, F, G, Н), а неспиральные участки или углы поворота спиралей имеют соответствующее обозначение (АВ, ВС, CD, DE и т. д.). Неспиральные участки на аминном (N) или карбоксильном (С) конце цепи глобина обозначают соответственно NA или НС. Аминокислотные остатки нумеруются в каждом сегменте и, кроме того, в скобках дается нумерация данного остатка от N-конца цепи.
Спиральные и неспиральные участки определенным образом уложены в пространстве, что определяет третичную структуру цепей глобина. Последняя почти идентична у альфа- и бета-цепей Г., несмотря на значительные различия в их первичной структуре. Это обусловлено специфическим расположением полярных и гидрофобных групп аминокислот, приводящим к скоплению неполярных групп во внутренней части глобулы с образованием гидрофобного ядра. Полярные группы белка обращены к водной среде, находясь с ней в контакте. Внутри каждой цепи глобина недалеко от поверхности находится гидрофобная впадина («гемовый карман»), в к-рой располагается гем, ориентируясь так, что его неполярные заместители направлены во внутрь молекулы, входя в состав гидрофобного ядра. В результате возникает ок. 60 неполярных контактов между гемом и глобином и один-два полярных (ионных) контакта гема с альфа- и бета-цепями, в которых участвуют остатки пропионовой к-ты гема, выходящие наружу из гидрофобного «кармана». Расположение гема в гидрофобной впадине глобина обеспечивает возможность обратимого присоединения кислорода к Fe 2+ гема без окисления последнего до Fe 3+ и характерно для гемоглобинов различных видов животных. Подтверждением этого является крайняя чувствительность Г. к любым изменениям неполярных контактов вблизи гема. Так, замена гема в Г. на гематопорфирин приводит к резкому нарушению свойств Г.
Некоторые аминокислотные остатки, окружающие гем в гидрофобной впадине, относятся к числу инвариантных аминокислот, т. е. аминокислот, одинаковых для различных видов животных и существенных для функции Г. Среди инвариантных аминокислот большое значение отводится трем: остаткам гистидина, так наз. проксимальным гистидинам (87-я позиция в а- и 92-я позиция в P-цепях), дистальным гистидинам (58-я позиция в а- и 63-я позиция в (5-цепях), a также остатку валина Е-11 (62-я позиция в альфа-цепи и 67-я позиция в бета-цепи).
Связь между так наз. проксимальным гистидином и железом гема является единственной хим. связью между ними (реализуется пятая координационная связь атома Fe 2+ гема) и непосредственно влияет на присоединение кислорода к гему. «Дистальный» гистидин непосредственно не связан с гемом и участия в фиксировании кислорода не принимает. Его значение состоит в стабилизации атома Fe 2+ против необратимого окисления (по-видимому, за счет образования водородной связи между кислородом и азотом). Остаток валина (Е-11) является своего рода регулятором скорости присоединения кислорода к гемам: в бета-цепях он стерически расположен так, что занимает то место, куда должен присоединиться кислород, вследствие чего оксигенация начинается с фльфа-цепей.
Белковая часть и простетическая группа молекулы Г. оказывают друг на друга сильное влияние. Глобин изменяет многие свойства гема, придавая ему способность к связыванию кислорода. Гем обеспечивает устойчивость глобина к действию к-т, нагреванию, расщеплению ферментами и обусловливает особенности кристаллизационных свойств Г.
Полипептидные цепи с присоединенными к ним молекулами гема образуют четыре основные части — субъединицы молекулы Г. Характер соединения (укладки) их между собой ц расположение в пространстве определяют особенности четвертичной структуры Г.: а- и P-цепи располагаются по углам тетраэдра вокруг оси симметрии, причем альфа-цепи лежат поверх p-цепей и как бы втискиваются между ними, а все четыре гема далеко удалены друг от друга (рис. 3). В целом образуется тетрамерная сфероидная частица с размерами 6,4 X 5,5 х 5,0 нм. Четвертичная структура стабилизирована солевыми связями между α—α- и β-β-цепями и двумя видами контактов между α и β-цепями (α1-β1 и α2-β2). Контакты α1-β1 наиболее обширны, в них участвуют 34 аминокислотных остатка, большинство взаимодействий неполярно. Контакт α1-β2 включает 19 аминокислотных остатков, большинство связей также неполярно, за исключением нескольких водородных связей. Все остатки, находящиеся в этом контакте, одинаковы у всех изученных видов животных, в то время как 1/3 остатков в α1-β1-контактах варьирует.
Г. человека гетерогенен, что обусловлено различием полипептидных цепей, входящих в его состав. Так, Г. взрослого человека, составляющий 95—98% Г. крови (HbA), содержит две α- и две β-цепи; малая фракция Г. (HbA2), достигающая максимального содержания 2,0—2,5%, содержит две α- и две σ-цепи; гемоглобин плода (HbF), или фетальный гемоглобин, составляющий в крови взрослого человека 0,1—2% , состоит из двух α- и двух γ-цепей.
Фетальный Г. заменяется на HbA в первые месяцы после рождения. Он характеризуется значительной устойчивостью к тепловой денатурации, на чем основаны методы определения его содержания в крови.
В зависимости от состава полипептидных цепей перечисленные типы Г. обозначаются следующим образом: HbA — как Hbα2β2, HbA2 — как Hbα2σ2, a HbF — как Hbα2γ. При врожденных аномалиях и заболеваниях кроветворного аппарата появляются аномальные типы Г., напр, при серповидноклеточной анемии (см.), талассемии (см.), врожденной метгемоглобинемии неэнзиматического происхождения (см. Метгемоглобинемия) и др. Наиболее часто встречается замещение единственной аминокислоты в одной паре полипептидных цепей.
В зависимости от величины валентности атома железа гема и типа лиганда в молекуле Г. последний может находиться в нескольких формах. Восстановленный Г. (дезокси-Hb) имеет Fe 2+ со свободной шестой валентностью, при присоединении к нему O2 образуется оксигенированная форма Г. (HbO2). При действии на HbO2 ряда окислителей (феррицианид калия, нитриты, хиноны и др.) происходит окисление Fe 2+ до Fe 3+ с образованием метгемоглобин, неспособного к переносу O2. В зависимости от величины pH среды различают кислую и щелочную форму метгемоглобина, содержащих в качестве шестого лиганда H2O или OH-группу. В крови здоровых людей концентрация метгемоглобина составляет 0,83+0,42% .
Метгемоглобин обладает способностью прочно связывать фтористый водород, синильную к-ту и другие вещества. Этим его свойством пользуются в мед. практике для спасения людей, отравленных синильной к-той. Различные производные Г. различаются по спектрам поглощения (табл.).