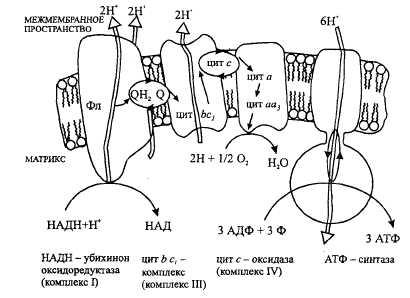
Дыхательная цепь митохондрий витамины
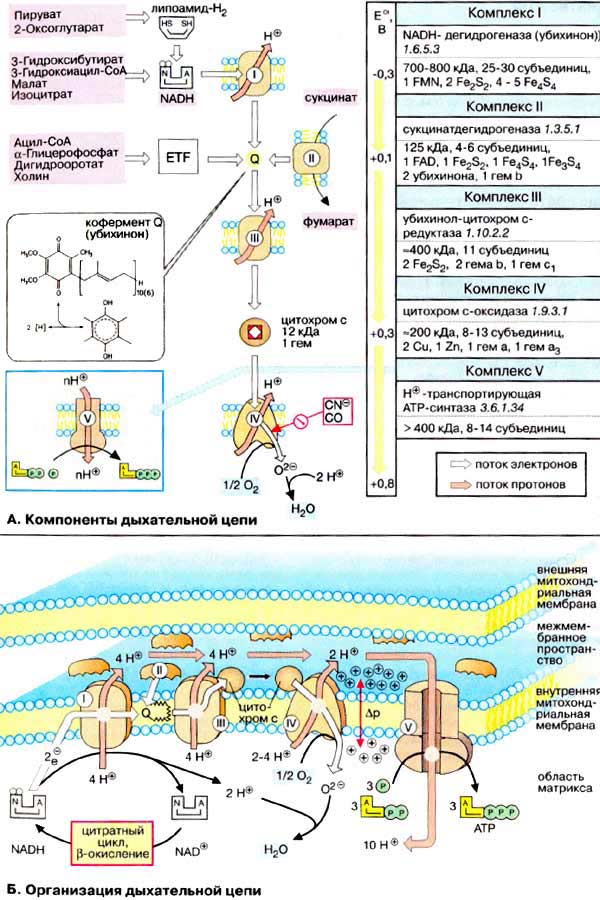
А. Компоненты дыхательной цепи
Дыхательная цепь включает три белковых комплекса ( комплексы I, III и IV ), встроенных во внутреннюю митохондриальную мембрану, и две подвижные молекулы-переносчики — убихинон (кофермент Q) и цитохром с. Сукцинатдегидрогеназа , принадлежащая собственно к цитратному циклу, также может рассматриваться как комплекс II дыхательной цепи. АТФ-синтаза (см. с. 144) иногда называется комплексом V , хотя она не принимает участия в переносе электронов.
Комплексы дыхательной цепи построены из множества полипептидов и содержат ряд различных окислительно-восстановительных коферментов , связанных с белками (см. сс. 108, 144). К ним принадлежат флавин [ФМН (FMN) или ФАД (FAD), в комплексах I и II], железо-серные центры (в I, II и III) и группы гема (в II, III и IV). Детальная структура большинства комплексов еще не установлена.
Электроны поступают в дыхательную цепь различными путями. При окислении НАДН + Н + комплекс I переносит электроны через ФМН и Fe/S-центры на убихинон. Образующиеся при окислении сукцината, ацил-КоА и других субстратов электроны переносятся на убихинон комплексом II или другой митохондриальной дегидрогеназой через связанный с ферментом ФАДН 2 или флавопротеин (см. с. 166), При этом окисленная форма кофермента Q восстанавливается в ароматический убигидрохинон . Последний переносит электроны в комплекс III , который поставляет их через два гема b, один Fe/S-центр и гем с 1 на небольшой гемсодержащий белок цитохром с . Последний переносит электроны к комплексу IV, цитохром с-оксидазе. Цитохром с-оксидаза содержит для осуществления окислительно-восстановительных реакций два медьсодержащих центра (Cu A и Cu B ) и гемы а и а 3 , через которые электроны, наконец, поступают к кислороду . При восстановлении О 2 образуется сильный основной анион О 2- , который связывает два протона и переходит а воду. Поток электронов сопряжен с образованным комплексами I, III и IV протонным градиентом .
Б. Организация дыхательной цепи
Перенос протонов комплексами I, III и IV протекает векторно из матрикса в межмембранное пространство. При переносе электронов в дыхательной цепи повышается концентрация ионов H + , т. е. понижается значение рН. В интактных митохондриях по существу только АТФ-синтаза (см. с. 144) позволяет осуществить обратное движение протонов в матрикс. На этом основано важное в регуляторном отношении сопряжение электронного переноса с образованием АТФ (см. с. 146).
Как уже упоминалось, все комплексы с I по V интегрированы во внутренней мембране митохондрий, тем не менее обычно они не контактируют друг с другом, так как электроны переносятся убихиноном и цитохромом с. Убихинон благодаря неполярной боковой цепи свободно перемещается в мембране. Водорастворимый цитохром с находится на внешней стороне внутренней мембраны.
Окисление НАДН (NADH) комплексом I происходит на внутренней стороне мембраны, а также в матриксе, где происходит также цитратный цикл и β-окисление — самые важные источники НАДН. В матриксе протекают, кроме того, восстановление O 2 и образование АТФ (ATP). Полученный АТФ переносится по механизму антипорта (против АДФ) в межмембранное пространство (см. с. 214), откуда через порины проникает в цитоплазму.
Источник
Митохондриальная медицина.
Часть 2
Ольга Борисова
15 декабря 2019
Обновление: 26 февраля 2020
К консервативной поддержке функций митохондрий, относится, в первую очередь, физическая нагрузка, а также питание, прием витаминно-минеральных комплексов, различных растительных препаратов и их экстрактов. Основным принципом действия данной группы методов является так называемый митогормезис — «закаливание» митохондрий. Небольшие стрессовые воздействия стимулируют ответ митохондрий, что выражается в увеличении их динамики, процессов митофагии (саморазрушения) и биогенеза, что способствует удалению повреждённых митохондрий и образованию новых.
Основной «мессенджер» стрессовых воздействий, запускающий адаптацию — реактивные формы кислорода (РФК). Свободные радикалы становятся негативным фактором только в тех случаях, когда клетка не может адекватно реагировать на рост их концентрации. Поэтому использование антиоксидантов при спортивных нагрузках и применении любых препаратов, основанных на митогормезисе, снижает их эффективность.
Физическая активность до сих пор является наиболее оптимальным и доказанным способом улучшения митохондриальной функции. Регулярные тренировки в течение всего одного месяца увеличивают содержание митохондрий на 30–100%, а их объемную плотность — на 40%. Систематические регулярные тренировки в течение полугода индуцируют системный биогенез митохондрий (который состоит из циклов их деления и слияния, необходимых для контроля качества), предотвращают истощение митохондриальной ДНК, снижают количество мутаций, увеличивают окислительную емкость и улучшают морфологию митохондрий.
Биогенез митохондрий повышает такой параметр, как VOmax (максимальное поглощение кислорода митохондриями в течение минуты), оптимизирует процессы поглощения кислорода для окислительного фосфорилирования и окисления жирных кислот. Сокращение мышцы запускает как минимум четыре внутриклеточных сигнальных пути, которые контролируют работу митохондрий через рост внутриклеточного уровня кальция, падение соотношения АТФ/АМФ, рост соотношения НАД+/НАДН, увеличение образование РФК. Все эти пути через фермент-посредник АМРК (цАМФ-зависимая протеинкиназа) влияют на белок PGC1α — ключевой мастер-регулятор митохондриального биогенеза. РФК действует также через регулирующий клеточный цикл фактор р53.
При этом как и длительные тренировки умеренной интенсивности, так и высокоинтенсивный интервальный тренинг (ВИИТ) и даже интервальный спринт (который считается типично анаэробной нагрузкой и занимает 10 мин в неделю) запускают сходные изменения маркеров биогенеза митохондрий: увеличение уровней PGC1α, а также митохондриальных ферментов цитратсинтазы и цитохром-с-оксидазы. Хотя, по всей видимости, только длительные тренировки приводят к увеличению количества митохондрий, а кратковременные интервальные,скорее,влияют на эффективность существующих, меняя их ультраструктуру и оптимизируя работу дыхательной цепи (Jesus R. Huertas, 2019).
По влиянию питания на работу митохондрий в интернете можно найти массу информации с той или иной степенью достоверности. Самое важное — обеспечить переключение энергетический субстратов с сжигания углеводов на сжигание жиров (это достигается, в первую очередь, за счет периода ночного голода не меньше 12 часов), а переедание и вызываемая им «перегрузка» субстратом однозначно нарушает работу митохондрий.
Не слишком длительные периоды голода стимулируют динамику митохондрий, положительно влияя на системы контроля качества и работу дыхательной цепи. Более подробно о механизмах можно почитать в работах (1, 2, 3, 4).
Для нормальной работы дыхательной цепи необходимо адекватное (а не избыточное) поступление цинка, магния, витаминов группы В (В1, В2, В3,В6, В7, В12, В5, В9), витамина С, витамина Е.
Магний — важный макроэлемент, который необходим для поддержания гомеостаза митохондрий, а также для работы фермента теломеразы. Больше всего внутриклеточного магния находится внутри митохондрий в комплексе с АТФ. С возрастом его количество падает. При этом магний необходим для поддержания гомеостаза митохондрий, а также для работы фермента теломеразы. К функциям теломеразы, помимо удлинения концевых участков хромосом — теломер, относится, в том числе, поддержание митохондриальной функции (D. Maguire и др., 2018).
На работу митохондрий также влияет ряд компонентов, которые часто используются в биологически активных добавках (БАД), таких, как, коэнзим Q, карнитин, нитраты, кофеин, альфа-липоевая кислота, таурин, мелатонин. Правда, эффективность далеко не всех из них доказана и зависит от возрастной группы, степени дисфункции митохондрий и др. Пищевые нитраты представляют особый интерес для спортсменов: они снижают кислородную стоимость внешнего дыхания, увеличивают эффективность работы дыхательной цепи (на одну молекулу кислорода производится больше АТФ). Возможный механизм этих процессов — снижение работы АТФ/АДФ транслоказы — транспортёра этих молекул на мембране митохондрий (J.R. Huertas и др., 2019).
Жирные кислоты очень важны для работы митохондрий в качестве строительного материала их мембран. При этом количество не переходит в качество, и диета с высоким содержанием жиров существенно снижала содержание линолеата кардиолипина (основной компонент внутренней мембраны митохондрий) в сердцах крыс. Большое количество пальмитиновой жирной кислоты, потенциально может приводить к нарушению конкуренции энергетических субстратов, так как для нее в митохондриях есть свой транспортер. Олеиновая кислота входит в состав кардиолипина (G. Paradies и др., 2019). Стеариновая ЖК (содержится в какао-бобах) стимулирует динамику митохондрий, что в небольших количествах может иметь положительное воздействие (Senyilmaz-Tiebe и др., 2018).
Питание влияет на митохондрии не только как энергетический субстрат, но может оказывать свое воздействие через микрофлору кишечника.
Источник
43. Дыхательная цепь в митохондриях
Система структурно и функционально связанных трансмембранных белков и переносчиков электронов. Она позволяет запасти энергию, выделяющуюся в ходе окисления NAD*H и ФАДН2 молекулярным кислородом в форме трансмембранного протонного потенциала за счёт последовательного переноса электрона по цепи,сопряжённого с перекачкой протонов через мембрану. Транспортная цепь у эукариот локализована на внутренней мембране митохондрий. В дыхат.цепи 4 мультиферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ.
1.Принимает электроны от НАДН и передает их на коэнзим Q (убихинон). 2.Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
1.Восстановление ФАД 3ий-цитохром с-оксидоредуктаза.
2.Принимает электроны от коэнзима Q и передает их на цитохром с.
3.Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
4ый-цитохром с-кислород оксидоредуктаза.
1.Принимает электроны от цитохрома с и передает их на кислород с образованием воды.
2.Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. Все атомы водорода, отщепленные дегидрогеназами от субстратов в аэробных условиях, достигают внутренней мембраны митохондрий в составе НАДН или ФАДН2.
Электроны по мере передвижения теряют энергию->энергия тратиться комплексами на перекачку протонов Н.Перенос ионов Н происходит в строго определённых участках->участках сопряжения.Результат: происходит наработка АТФ: ионы H+ теряют свою энергию, проходя через АТФ-синтазу.Часть этой энергии тратится на синтез АТФ. Другая часть рассеивается в виде тепла.
Дыхательная цепь митохондрий состоит из 5 мультифер-ментных комплексов, субъединицы которых кодируются как ядерными, так и митохондриальными генами. В переноске электронов участвуют коэнзим Q10 и цитохром с. Электроны поступают от молекул NAD*H и FAD’H и переносятся по дыхательной цепи. Высвобождаемая энергия используется для транспорта протонов к внешней мембране митохондрий, а возникающий электрохимический градиент — для синтеза АТФ с помощью комплекса V дыхательной цепи митохондрий
44. Последовательность и строение переносчиков электронов в дыхательной цепи
1 комплекс. НАДН-КоQ-оксидоредуктаза
Этот комплекс также имеет рабочее название НАДН-дегидрогеназа, содержит ФМН (флавинмононуклеотид), 22 белковых молекулы, из них 5 железосерных белков с общей молекулярной массой до 900 кДа.
— Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
— Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
2 комплекс. ФАД-зависимые дегидрогеназы
Он включает в себя ФАД-зависимые ферменты, расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса НАДН в митохондрию).
— Восстановление ФАД в окислительно-восстановительных реакциях.
— Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q.
46. Биохимические механизмы разобщения окисления и фосфорилирования факторы их вызывающие Разобщение дыхания и фосфорилирования
Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. В этом случае скорость окисления NADH и FADH2возрастает, возрастает и количество поглощённого кислорода, но энергия выделяется в виде теплоты, и коэффициент Р/О резко снижается. Как правило, разобщители — липофильные вещества, легко проходящие через липидный слой мембраны. Одно из таких веществ — 2,4-динитрофенол (рис. 6-17), легко переходящий из ионизированной формы в неионизированную, присоединяя протон в межмембранном пространстве и перенося его в матрикс.
Примерами разобщителей могут быть также некоторые лекарства, например дикумарол — антикоагулянт (см. раздел 14) или метаболиты, которые образуются в организме, билирубин — продукт катаболизма тема (см. раздел 13), тироксин — гормон щитовидной железы (см. раздел 11). Все эти вещества проявляют разобщающее действие только при их высокой концентрации.
Выключение фосфорилирования по исчерпании АДФ либо неорганического фосфата сопровождается торможением дыхания (эффект дыхательного контроля). Большое число повреждающих митохондриальную мембрану воздействий нарушает сопряжение между окислением и фосфорилированием, разрешая идти переносу электронов и в отсутствие синтеза АТФ (эффект разобщения)
1. Суммарный выход:
Для синтеза 1 молекулы АТФ необходимо 3 протона.
2. Ингибиторы окислительного фосфорилирования:
Ингибиторы блокируют V комплекс:
Олигомицин — блокируют протонные каналы АТФ-синтазы.
Атрактилозид, циклофиллин — блокируют транслоказы.
3. Разобщители окислительного фосфорилирования:
Разобщители — липофильные вещества, которые способны принимать протоны и переносить их через внутреннюю мембрану митохондрий минуя V комплекс(его протонный канал). Разобщители:
Естественные — продукты перекисного окисления липидов, жирных кислот с длинной цепью; большие дозы тиреоидных гормонов.
Искусственные — динитрофенол, эфир, производные витамина К, анестетики.
Источник