Технология получения витамина С (L-аскорбиновая кислота)
Витамин С, необходимый для нормальной жизнедеятельности человека, впервые выделен из лимона. Он участвует во многих видах окислительновосстановительных процессов, положительно действует на нервную систему; выступает как мощный противоцинготный препарат.
Рис. 6.11. Строение витамина С
Витамин С синтезируют следующими способами:
— экстракция из растений;
— смешанный ферментативно-химический синтез.
В промышленных масштабах витамин С получают двумя способами:
1) метод Рейхштейна;
2) двухстадийный ферментативный синтез.
Метод Рейхштейна впервые использован в 1933 г. и до сих пор применяется компаниями «BASF», «Roshe», «Takeda». Его сущность заключается в двухстадийном превращении L-сорбозы в диацетонкетогулоновую кислоту. Процесс получения аскорбиновой кислоты представлен на рис. 6.12.
Рис. 6.12. Схема процесса получения аскорбиновой кислоты
Рис. 6.13. Схема ферментативного способа (а) и химизм получения L-аскорбиновой кислоты (б)
Технология включает 5 стадий:
1) получение D-сорбита из D-глюкозы методом каталитического восстановления глюкозы водородом при давлении 8-10 МПа и температуре 135140°C;
2) получение а-сорбозы из D-сорбита путем биохимического глубинного окисления;
3) получение диацетонсорбозы из сорбозы путем обработки сорбозы ацетоном в присутствии серной кислоты;
4) окисление диацетонсорбозы в диацетонкетогулоновую кислоту с помощью КМпО4 или других сильных окислителей;
5) образование аскорбиновой кислоты в среде органического растворителя (хлороформа или дихлорэтана) в присутствии соляной кислоты, после чего техническую аскорбиновую кислоту перекристаллизовывают в чистый продукт.
Известен способ получения аскорбиновой кислоты с помощью микроорганизмов. Питательной средой выступают глюкоза и дрожжи (
200 мг/г биомассы) либо грибы рода Fusarium или рода Aspergillus и бактерии Strepto- cocous thermopiles.
Витамин С выпускают в различных формах — в виде порошков, гранул, аскорбатов натрия и кальция (рис. 6.13, а) [6].
Получение витамина группы D
Под этим термином понимают несколько соединений, относящихся к стеринам; наиболее активными из них являются эргокальциферол (D2) (рис. 6.14) и холкальциферол (D3) [5].
Витамин D регулирует содержание кальция и неорганического фосфора в крови, участвует в минерализации костей. Его хронический дефицит приводит к развитию рахита у детей и разрежению костей у взрослых (остеопороз). Кальциферолы содержатся в продуктах животного происхождения — рыбьем жире, печени трески, яйцах. При избытке витамина D у детей и взрослых (гипер- витаминоз) развивается интоксикация. Витамин D не разрушается при кулинарной обработке, очень чувствителен к свету, действию кислорода.
Витамин D2 получают по технологической схеме, сходной с представленной на рис. 6.5.
Источник
6. Получение субстанции аскорбиновой кислоты является многостадийным процессом, в котором сочетаются методы органического и микробиологического синтеза.
Синтез витамина С осуществляют путем енолизации его важнейшего промежуточного продукта 2-кето-L-гулоновой кислоты, которую, в свою очередь, получают методом 2-х стадийного микробиологического синтеза, состоящего из окисления d-глюкозы в 2,5-дикето-d-глюконовую кислоту (2,5-ДКДГК) и биотрансформации последней в 2-кето-L-гулоновую кислоту (2-КГК).
Значение сокращение числа химических стадий за счет привлечения биотехнологических методов, увеличение выхода конечного продукта реакции, исключаются процессы, связанные с использованием высоких давлений, снижается металлоемкость аппаратуры и резко уменьшает количество вредных выбросов.
Процесс протекает при участии уксуснокислых бактерий.
Ситуационная задача 5
1. В кал поступило несколько серий лекарственного вещества следующей структуры:
Поступил: бензилпенициллина натриевая соль. Порошок во влажной среде гидролизуется до пеницилленовой кислоты, а органические кислоты в воде плохо растворяются.
Для определения качества используют кроме показателя растворимость: прозрачность и цветность раствора, удельное вращение, показатель поглощения, рН, потеря в весе при высушивании.
БЕНЗИЛПЕНИЦИЛЛИН НАТРИЕВАЯ СОЛЬ(Benzylpenicillinum natrium)
Белый мелкокристаллический порошок, слегка гигроскопичен. Удельное вращение от +285 до +310° (2%-ный водный раствор). Оень легко растворим в воде, растворим в этиловом и метиловом спирте.
Подлинность подтверждают с помощью УФ- и ИК-спектрофотометрии. Устанавливают значения оптических плотностей растворов солей бензилпенициллина при длинах волн 280 и 263 нм, разность между которыми должна быть не менее 0,72. ИК-спектр идентифицируют по совпадению с полосами поглощения соответствующих стандартных образцов в области 4000-400 см -1 . Подлинность бензилпенициллина натриевой соли устанавливают также методом ТСХ на силикагеле или пластинках Сорбфил с последующим проявлением в парах йода.
Важная физическая константа пенициллинов — удельное вращение водных или спиртовых растворов. Все они вращают плоскость поляризованного света вправо.
Подлинность
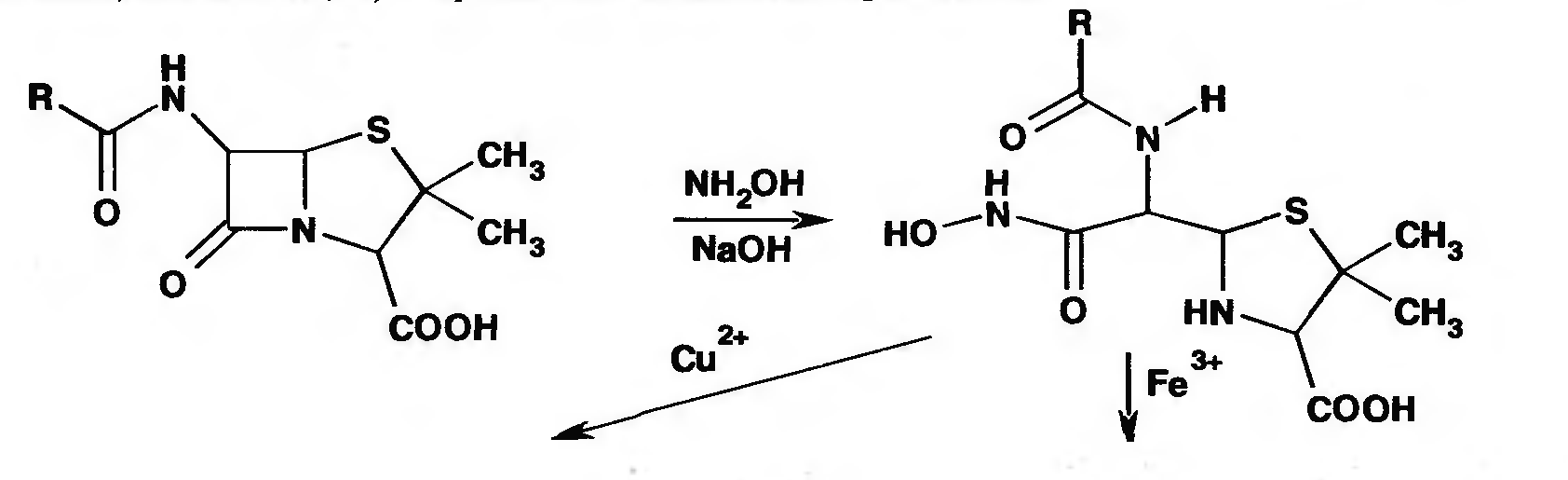
Для испытания подлинности пенициллинов используют цветную реакцию, основанную на разрыве бета-лактамного цикла с образованием внутрикомплексной соли меди (II) с гидроксамовой кислотой (осадок зеленого цвета) или железа (III) — красное или фиолетовое окрашивание:
Образование этих солей происходит только в определенных интервалах значений рН.
Во всех пенициллинах можно обнаружить органически связанную серу после превращения ее в сульфид-ион сплавлением с едкими щелочами. Сульфид-ион затем открывают по образованию красно-фиолетового окрашивания после добавления раствора нитропруссида натрия.
За счет иона натрия – пламя желтого цвета.
Соли бензилпенициллина дают положительную реакцию Витали-Морена. При выпаривании их с дымящей азотной кислотой и последующем прибавлении спиртового раствора гидроксида калия и ацетона появляется фиолетовое окрашивание.
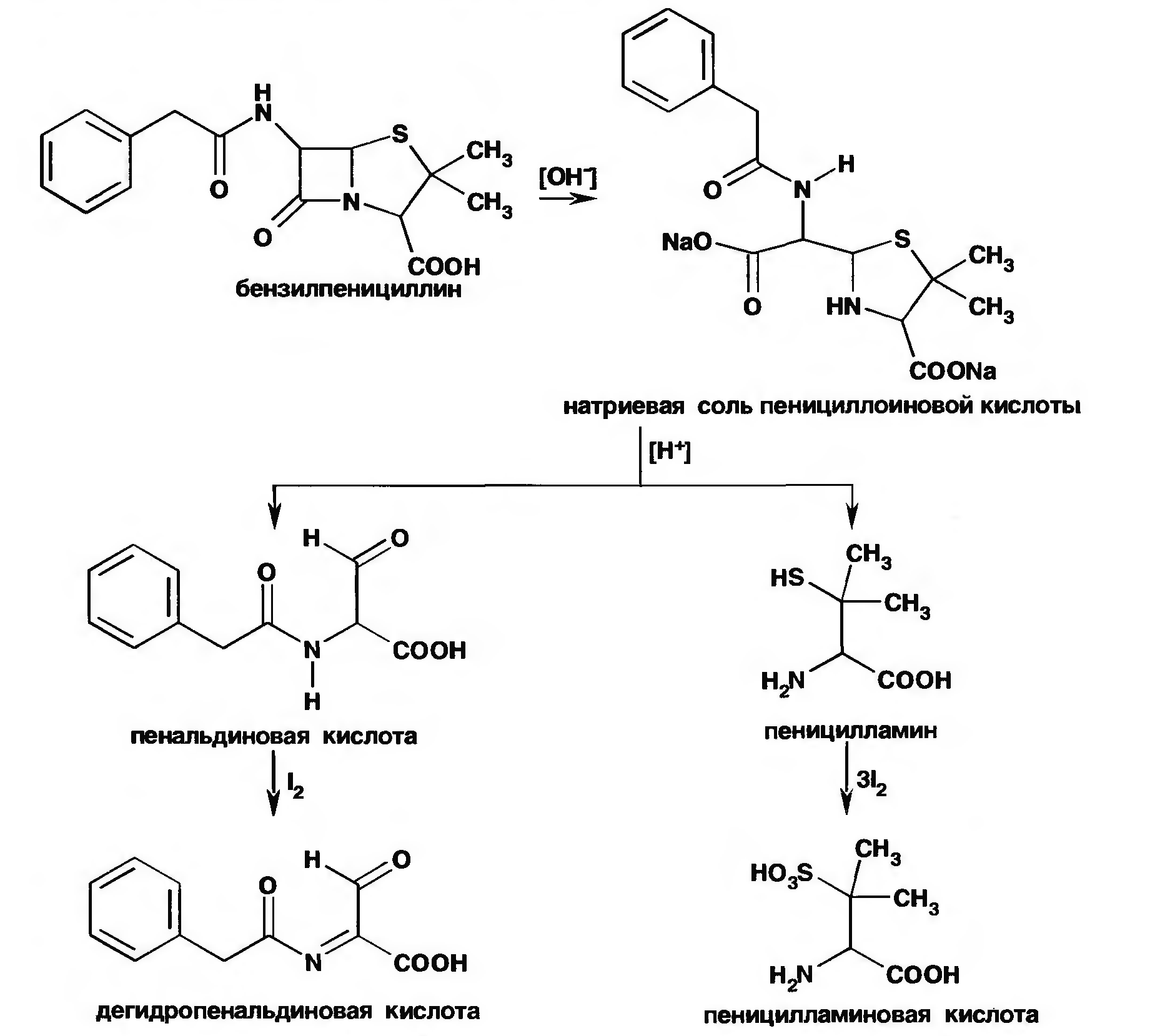
Соли бензилпенициллина при кипячении в 4%-ном растворе гидроксида натрия гидролизуются с образованием натриевой соли фенилуксусной кислоты, которая после добавления избытка разбавленной серной кислоты обнаруживается по характерному запаху.
Количественное определение пенициллинов выполняют химическими методами. В натриевой соли бензилпенициллина сумму пенициллинов определяют йодометрическим методом. Сущность способа заключается в том, что продукт инактивации пенициллина (1М раствором гидроксида натрия при комнатной температуре) — натриевую соль пенициллоиновой кислоты окисляют йодом. Процесс окисления необходимо проводить при рН 4,5 (ацетатный буфер).
Схема инактивации и окисления на примере бензилпенициллина:
Определение суммы пенициллинов выполняют обратным йодометрическим методом. Избыток 0,01 М раствора йода оттитровывают раствором тиосульфата натрия той же концентрации после 20 мин пребывания ее в темном месте (индикатор крахмал). Одновременно проводят контрольный опыт с тем же количеством пенициллина, не подвергнутого щелочному гидролизу, а также йодометрическое определение соответствующего ГСО.
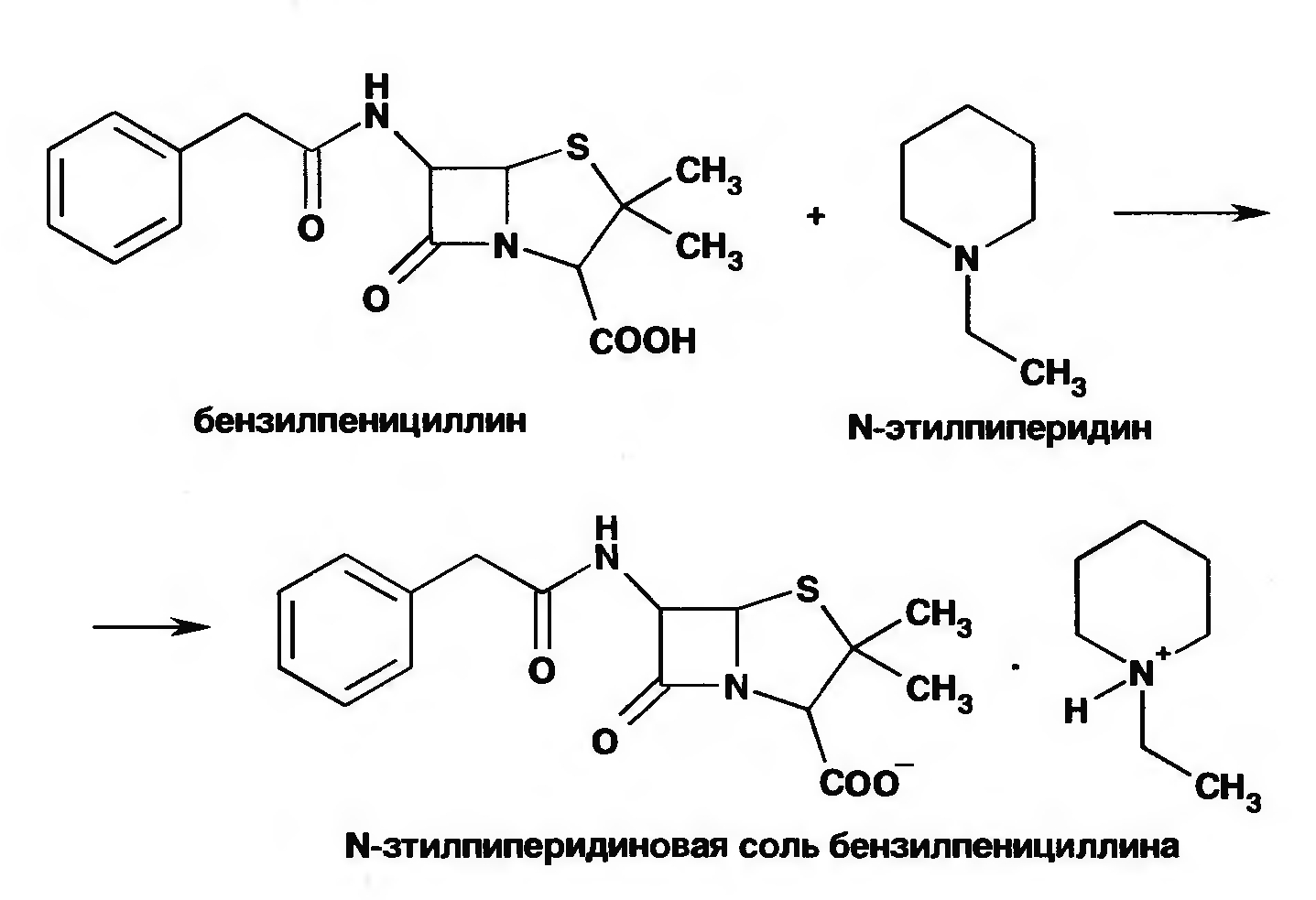
Количественное определение натриевой, соли бензилпенициллина выполняют гравиметрическим методом. Бензилпенициллин извлекают амилацетатом и количественно осаждают в виде N-этилпиперидиновой соли:
Осадок N-этилпиперидиновой соли бензилпенициллина промывают, высушивают до постоянной массы и взвешивают. Затем делают пересчет на соль.
Источник
6.4. Синтез l-аскорбиновой кислоты
В настоящее время для крупномасштабного производства L-аскорбиновой кислоты (витамина С) используют преимущественно трудоемкий процесс, включающий одну микробиологическую стадию и несколько химических. Исходным субстратом для него является D-глюкоза (рис. 16).
На последнем этапе этого процесса 2-кето-L-гулоновая кислота (2-I KLG) превращается в кислых условиях в L-аскорбиновую кислоту.
Биохимические исследования метеболизма различных микроорганизмов показали, что 2-KLG можно получить, включая совместное культивирование микроорганизмов Corynebacterium и Erwinica herbicola для превращения глюкозы в 2-KLG. Однако условия культивирования, оптимальные для одного организма, неприемлемы для другого, что влечет спонтанное «вымывание» из среды одного из них. В подобных случаях можно культивировать микроорганизмы последовательно, но такой процесс трудно сделать непрерывным, так как для роста микроорганизмов необходимы существенно разные среды (рис. 17).
Наиболее простой способ — создание одного микроорганизма, способного превращать D-глюкозу в 2-KLG, состоит в выделении гена
2,5-DКG-редуктазы Corynebacterium и введении его в Erwinica herbicola (рис. 18).
Трансформированные клетки Erwinica herbicola активно превращают D-глюкозу непосредственно в 2-KLG. При этом собственные ферменты Erwinica herbicola, локализованные во внутренней мембране бактериальной клетки, преобразуют глюкозу в 2,5-DKG (2,5-дикетоглюкановая кислота), а 2,5-DКG-редуктаза, локализованная в цитоплазме, катализирует процесс превращения 2,5-DKG в 2-KLG.
Следовательно, с помощью генетических манипуляций удалось в одном организме осуществить метаболические реакции, протекающие в столь разных микроорганизмах. Этот гибрид приобрел способность синтезировать конечный продукт комбинированного метаболического пути. Такой организм используется как фабрика для производства 2-KLG, заменяющая три стадии в том процессе получения L-аскор-биновой кислоты, который доминирует и в настоящее время.
6.5. Гормональные препараты
6.5.1. Инсулин
Инсулин синтезируется (3-клетками островков Лангерганса поджелудочной железы; 70% мРНК, выделенных из этих клеток, кодируют именно этот белок.
Человеческий инсулин — полипептид с м.м. 5808, состоящий из 51-й аминокислоты, которые образуют две соединенные дисульфидными мостиками полипептидные цепи (одна цепь состоит из 21 аминокислоты, так называемая цепь А; другая — из 30 аминокислотных остатков, так называемая цепь В). Аминокислотный состав цепей видоспецифи-чен. Предшественник инсулина продуцируется внутри Р-клеток посредством ДНК- и РНК-управляемого синтеза. Длинная цепь проинсулина в аппарате гольджи упаковывается в гранулы, где в результате гидролиза удаляются четыре аминокислоты (обозначенные пунктом на рис. 19) с образованием инсулина и связывающего пигмента, называемого С-пептидом. Инсулин и С-пептид в эквивалентных концентрациях секре-тируются в ответ на все стимуляторы секреции инсулина (глюкозу, маннозу и некоторые аминокислоты — лейцин, аргинин). Выделяется также небольшое количество нативного или частично гидролизованного проинсулина, который оказывает некоторое гипогликемическое действие. В гранулах р-клеток инсулин депонируется в виде кристаллов, состоящих из двух атомов цинка и шести молекул инсулина. В целом, человеческая поджелудочная железа содержит до 8 мг инсулина, что составляет приблизительно 200 биологических «единиц» (количество единиц определяют по массе препарата; существующий инсулиновый стандарт, используемый в аналитических целях, составляет 28 ЕД/мг).
Инсулин обладает мощным действием, охватывающим биосинтез нуклеиновых кислот, белков, обмен углеводов, липидов, продукцию высокоэнергетических соединений. Инсулин регулирует углеводный обмен, усиливает усвоение тканями глюкозы и способствует превращению ее в гликоген, облегчает проникновение глюкозы в клетки тканей. Будучи специфическим средством терапии сахарного диабета, инсулин снижает гепергликемию и глюкозурию, пополняет депо гликогена в мышцах и печени, уменьшает образование глюкозы, снимает диабетическую липемию, улучшает общее состояние больного. Единственное отличие больного человека от здорового в том, что здоровые получают
этот гормон благодаря собственной поджелудочной железе, больные — из рук государства.
Сахарным диабетом I типа — инсулинзависимым диабетом (ИЗСД) -официально больны свыше 3 млн российских граждан, «неофициально» — до 10 млн. Известно, что ИЗСД (тяжелая форма, при отсутствии лечения приводящая к кетозу), наряду с сердечно-сосудистыми и онкологическими заболеваниями занимает одно из ведущих мест по медико-социальной значимости и является причиной ранней инвалидности и высокой смертности. Диабет II типа — инсулиннезависимый (ИНЗСД) включает более легкие формы диабета. Диабетом этого типа чаще болеют тучные люди.
История открытия инсулина связана с именем русского врача И.М. Соболева (вторая половина 19 в.), доказавшего, что уровень сахара в крови человека регулируется специальным гормоном поджелудочной железы.
В 1922 г. инсулин, выделенный из поджелудочной железы животного, был впервые введён 10-летнему мальчику (Торонто), больному диабетом. Результат превзошёл все ожидания, и уже через год американская фирма «Eli Lilly» выпустила первый препарат животного инсулина. Поджелудочная железа крупного рогатого скота (КРС) и свиней поставляется бойнями, где опытный персонал по разработанной методике извлекает железы из туш, их быстро замораживают (оптимальная температура — 70 °С) и в вагонах-рефрежераторах направляют на фармацевтические предприятия, где экстрагируют гормон. Масса поджелудочной железы КРС составляет в среднем 200-250 г, для получения 100 г кристаллического инсулина требуется 1000-1200 кг исходного сырья. Бычий (говяжий) гормон, в отличие от свиного, обладает несколько большей антигенностью для человека. После получения первой промышленной партии инсулина в последующие несколько лет пройден огромный путь его выделения и очистки, в результате гормон стал доступен для лечения больных сахарным диабетом 1 типа. Для адекватного контроля уровня глюкозы в крови инсулин нужно было вводить подкожно 4 раза в сутки.
В 1935 г. датский исследователь Хагедорн оптимизировал действие инсулина в организме, предложив пролонгированный препарат — про-тамин-цинк-инсулин (вводили один раз в сутки).
Первые кристаллы инсулина были получены в 1952 г.; развитие методов очистки гормона (иммуноэлектрофорез, ВЭЖХ) от других гормональных веществ (глюкагона — антагониста инсулина и соматостатина, последний подавляет выделение инсулина и глюкагона) и продуктов деградации инсулина позволили получить гомогенный инсулин, называемый однокомпонентным.
В 1954 г. английский биохимик Г. Сенджер получил Нобелевскую премию за расшифровку структуры инсулина.
Синтез обеих цепей инсулина и соединение их дисульфидными связями был проведён в 1963-1965 гг. В начале 70-х гг. советскими учёными А. Юдаевым и С. Швачкиным был предложен химический синтез инсулина. Осуществить в промышленном масштабе столь дорогостоящий и сложный синтез полипептидного гормона, состоящего из десятков аминокислотных остатков, нерентабельно, в том числе и по причине малого выхода.
В 70-е гг. 20 в. шло прогрессирующее улучшение степени очистки инсулинов, что уменьшило проблемы, обусловленные инсулиновой аллергией, нарушениями работы почек, расстройством зрения и иммунной резистентностью к инсулину. Со времени открытия и до начала 80-х гг. использовали инсулин, получаемый из поджелудочной железы КРС и свиней. Инсулин КРС отличается тремя аминокислотами, свиной — одной аминокислотой от инсулина человека. Наиболее эффективный гормон для заместительной терапии при сахарном диабете — гомологичный инсулин, т.е. инсулин человека.
В 1980 г. датская фармацевтическая компания «Novo» разработала метод превращения инсулина свиньи в инсулин человека ферментативным замещением аланина, последний является 30-й аминокислотой в цепи В, на остаток треонина с последующей хроматографической очисткой продукта, в результате был получен однокомпонентный инсулин человека 99% чистоты.
Достижения молекулярной биологии позволили установить, что биосинтез инсулина в р-клетках островковой ткани происходит по следующим основным этапам:
-закодированная информация о структуре гормона содержится в инсулиновом гене (участок ДНК) 11-й хромосомы;
— в результате стимулирующего действия, прежде всего глюкозы и некоторых других веществ, эта информация списывается РНК-полимеразой с инсулинового гена в виде мРНК на рибосомах, в которых осуществляется соединение аминокислот с образованием белков. На рибосомах происходит сборка полипептидной цепи из 109 аминокислот с образованием препроинсу-
лина под влиянием рестриктаз, в результате образуются фрагменты от нескольких сотен до нескольких тысяч нуклеотидов;
-при синтезе препроинсулина в р-клетках поджелудочной железы первые 23 аминокислоты «проводят» молекулу через мембрану клетки. Эти аминокислоты отщепляются рестриктазами и образуется пептид проинсулин, состоящий из 86 аминокислот. Молекула проинсулина сворачивается таким образом, что начальный и конечный её сегменты сближаются, а центральная часть молекулы удаляется под влиянием ферментов рестрикции; роль центральной части сводится к правильному взаимному расположению двух цепей инсулина.
В Великобритании с помощью Е. coli синтезированы обе цепи человеческого инсулина, которые затем были соединены в молекулу биологически активного гормона. Чтобы одноклеточный организм мог синтезировать на своих рибосомах молекулы инсулина, необходимо снабдить его нужной программой, т.е. ввести ему ген гормона. Химическим способом (операцию проводят специалисты биохимики) получают ген, программирующий биосинтез предшественника инсулина или два гена, программирующие в отдельности биосинтез цепей А и В инсулина. Следующий этап — включение гена предшественника инсулина (или гены цепей инсулина порознь) в геном Е. coli — особого штамма кишечной палочки, выращенного в лабораторных условиях; эту задачу выполняет генная инженерия. Из Е. coli вычленяют плазмиду соответствующей рестриктазой. Синтетический ген встраивается в плазмиду (клонированием с функционально активной С-концевой частью (B-галактозидазы Е. coli). В результате Е. coli приобретает способность синтезировать белковую цепь, состоящую из галактозидазы и инсулина. Синтезированные полипептиды отщепляют от фермента химическим путём, затем проводят их очистку. В бактериях синтезируется около 100000 молекул инсулина на бактериальную клетку.
Природа гормонального вещества, продуцируемого Е. coli, обусловлена тем, какой ген встраивается в геном одноклеточного организма. Если клонирован ген предшественника инсулина, бактерия синтезирует предшественник инсулина, который подвергается затем обработке рестриктазами для отщепления препептида с вычленением С-пептида, вследствие чего получается биологически активный инсулин. Для получения очищенного инсулина человека выделенный из биомассы гибридный белок подвергают химико-ферментативной трансформации и
соответствующей хроматографической очистке (фронтальной, гель-проникающей, анионообменной).
В Институте биоорганической химии РАН получен рекомбинант-ный инсулин с использованием генно-инженерных штаммов Е. coli. Из ■ выращенной биомассы выделяется предшественник, гибридный белок, экспрессируемый в количестве 40% от всего клеточного белка, содержащий препроинсулин. Превращение его в инсулин in vitro осуществляется в той же последовательности, что и in vivo — отщепляется лидирующий полипептид, препроинсулин превращается в инсулин через стадии окислительного сульфитолиза с последующим восстановительным замыканием трёх дисульфидных связей и ферментативным вычленением связывающего С-пептида. После ряда хроматографических очисток, включающих ионообменные, гелевые и ВЭЖХ, получают человеческий инсулин высокой чистоты и природной активности.
Использование аффинной хроматографии значительно снизило содержание в препарате загрязняющих белков с более высокой м.м., чем у инсулина. К таким белкам относятся проинсулин и частично расщепленные проинсулины, которые способны индуцировать выработку ан-тиинсулиновых антител. Стандартизация инсулина по загрязнению классифицирует препараты на обычные, содержащие проинсулина более 1%, монопиковые — менее 0,3% п, улучшенные монопиковые — менее 0,005% и монокомпонентные, содержащие менее 0,001% проинсулина.
Использование человеческого инсулина с самого начала терапии сводит к минимуму возникновение аллергических реакций. Наиболее частые осложнения инсулиновой терапии — гипогликемические состояния, основными признаками избытка инсулина являются нарушения функции ЦНС (спутанность сознания, странное поведение, кома).
Компания «Eli Lilly» в массовом производстве человеческого инсулина использует технологию рекомбинантных ДНК, помещая кДНК гена человеческого проинсулина в Е. coli или S. serevisae и гидролизуя наработанный проинсулин до молекулы инсулина. Человеческие инсу-лины этой фирмы носят название «Хумулин». В медицинской практике используют рекомбинатные человеческие инсулины из серии Хумулин («Eli Lilly») — регулярный, НПХ, ленте, ультраленте и их комбинированные составы. Человеческий инсулин быстрее абсорбируется и независимо от формы препарата имеет более короткую длительность действия, чем животные инсулины. Человеческие инсулины менее иммуно-генны, чем свиные, особенно смешанные бычьи и свиные инсулины.
В молекуле инсулина обнаружены области, играющие повышенную роль в его физико-химических и биологических свойствах. При внесении мутационных изменений в аминокислотную последовательность этих областей, существенным образом изменяются свойства молекулы з целом. Удалось получить аналоги с модификацией В-цепи, что привело к значительному увеличению гормональной активности по сравнению с природным инсулином.
Контроль качества генноинженерного инсулина предполагает контроль дополнительных показателей, характеризующих стабильность рекомбинантного штамма и плазмиды, отсутствие постороннего генетического материала в препарате, идентичность экспрессируемого гена и др. (всего 22 показателя).
В настоящее время в медицинской практике используют инсулины трех типов:
короткодействующие с быстрым началом эффекта;
средней продолжительности действия;
длительного действия с медленным проявлением эффекта.
Инсулин короткого действия — регулярный инсулин — представляет собой короткодействующий растворимый при нейтральном значении рН кристаллический цинк-инсулин, эффект которого развивается в течение 15 мин после подкожного введения и продолжается 5-7 ч.
С целью увеличения длительности действия все другие препараты инсулина модифицированы и при растворении в нейтральной среде образуют суспензию. Они содержат протамин в фосфатном буфере — про-тамин-цинк-инсулин и НПХ (нейтральный протамин Хагедорна) — НПХ-инсулин или различные концентрации цинка в ацетатном буфере —инсулины ультраленте, ленте, семиленте.
Препараты инсулина средней длительности действия содержат протамин, представляющий белок средней м.м. 4400, богатый аргинином и получаемый из молок радужной форели. Для образования комплекса требуется соотношение протамина и инсулина 1:10. После подкожного введения протеолитические ферменты разрушают протамин, позволяя инсулину всасываться.
НПХ-инсулин не изменяет фармакокинетический профиль смешиваемого с ним регулярного инсулина. НПХ-инсулин предпочтительнее инсулина ленте в качестве компонента средней длительности действия в терапевтических смесях, содержащих регулярный инсулин.
В фосфатном буфере все инсулины (свиной, бычий, человеческий) легко образуют кристаллы с цинком, но только кристаллы бычьего инсулина обладают достаточной гидрофобностью, чтобы обеспечить замедленное и стабильное высвобождение инсулина, характерного для ультраленте. Цинковые кристаллы свиного инсулина растворяются быстрее, эффект наступает раньше, длительность действия короче. Поэтому не существует препарата ультраленте, содержащего только свиной инсулин. Монокомпонентный свиной инсулин выпускают под названием инсулин-суспензия, инсулан-нейтрал, инсулин-изофан, инсулин-аминохинурид.
Инсулин ленте — это смесь 30% инсулина семиленте (аморфный преципитат инсулина с ионами цинка в ацетатном буфере, эффект которого развеивается относительно быстро) с 70% инсулина ультраленте (плохо растворимый кристаллический цинк-инсулин, имеющий замедленное начало и пролонгированное действие). Эти два компонента обеспечивают комбинацию с относительно быстрой абсорбцией и стабильным длительным действием, делая инсулин-ленте удобным терапевтическим средством.
При введении инсулина в виде аэрозоля на слизистую оболочку носа эффективный уровень препарата в плазме достигается быстро, однако, длительное интраназальное введение инсулина оказывает токсическое действие на слизистую оболочку.
Источник