Витамин К2
Витамин К является жирорастворимым витамином. Витамин К принимает участие в метаболизме костной и соединительной ткани, отвечает за процесс свертывания крови. Существует в трех изоформах: витамин К1 (филлохинон), витамин К2 (менахиноны) и витамин К3 (менадион), которые отличаются друг от друга длиной и насыщенностью боковой цепи. К1 и К2 являются природными формами витамина К, К3 — синтетической и присутствует только в добавках.
Витамин К1 синтезируется растениями, поэтому основными источниками являются темно-зеленые листовые овощи, растительные масла. Витамин К2 является продуктом жизнедеятельности бактерий и содержится в сброженных продуктах и продуктах животного происхождения. Незначительная часть витамина К2 синтезируется в толстом кишечнике. Считается, что менахиноны вносят меньший вклад, чем филлохинон, в общее потребление витамина К в современном рационе.
Витамин К2 представлен несколькими химическими вариантами (витамеры), которые сокращенно называются MK-n, где «n» указывает количество изопренильных звеньев в боковой цепи. Наиболее распространенной МК у человека является короткоцепочечный МК-4, образуется в результате превращения К1 в МК-4. Длинноцепочечные формы МК, МК-7 до МК-10, встречаются реже в организме человека. Когда количество изопренильных звеньев в боковой цепи молекулы витамина равно 0, это химическая формула называется витамином К3.
Абсорбция и выведение
Витамин К, поступающий с пищей, всасывается в тонком кишечнике. После всасывания обе формы витамина попадают в печень. Большая часть витамина К1, поглощенная печенью, метаболизируется и выводится из организма. Сравнительно небольшое количество витамина К1 вновь попадает в системный кровоток. Витамин К2 транспортируется во внепеченочные ткани и кости. Короткоцепочные формы МК-4 хранятся в мозге, репродуктивных органах, поджелудочной железе и других железах, депо для длинноцепочных форм является печень. Запасы витамина К малы, поэтому организм многократно использует витамин К, уменьшая потребность в нем. С возрастом всасывание витамина К снижается. Наличие хронических заболеваний кишечника, прием антибиотиков, непрямых антикоагулянтов и других лекарств негативно сказывается на поглощении витамина клетками кишечника.
Функции витамина К
Витамин К необходим для правильной работы витамин К-зависимых белков, которых в организме порядка 14. К ним относятся факторы свертывания крови (VII, IX, X, протромбин), протеин С, протеин S, образующиеся в печени; трансмембранные белки; белки костной ткани — остеокальцин, MGP. Витамин К2 играет роль кофактора в реакциях карбоксилирования витамин К-зависимых белков костей.
Витамин К-зависимые белки
Остеокальцин — это один из распространенных неколлагеновых белков костного матрикса. Остеокальцин образуют остеобласты. В процессе синтеза и секреции белка остеокальцина происходит связывание с кристаллами гидроксиапатита. Реакция связывания зависит от присутствия витамина К2. Наличие витамина К2 обеспечивает протекание реакции активации остеокальцина и перехода его в связанную форму, тем самым обеспечивая нормальную минерализацию костей. Небольшая часть остеокальцина выходит в кровоток, 40% циркулирующего остеокальцина находится в недокарбоксилированной форме. Остеокальцин крови является маркером формирования костной ткани и позволяет косвенно судить о процессе ремоделирования кости. Повышение концентрации остеокальцина указывает на повышение скорости костного обмена и связано с такими состояниями как остеопороз, гиперпаратиреоз, хроническая почечная недостаточность, диффузный токсический зоб, опухоли и метастазы, быстрый рост у подростков. Низкие значения остеокальцина говорят о снижении скорости костного обмена. Такие состояния наблюдаются при остеопорозе, вызванным применением глюкокортикоидами, гипопаратиреозе, болезни и синдроме Иценко-Кушинга, дефиците соматотропного гормона.
Белок Matrix Gla (MGP) обнаружен в хряще, кости и мягких тканях, включая стенки кровеносных сосудов. MGP появляется раньше, чем остеокальцин и связывается как с органическими, так и с гидроксиаппатитовыми кристаллами кости. Активация MGP предотвращает отложение Са2+ и замедляет процесс кальцификации в хряще, стенке сосудов, волокнах кожи и трабекулах глаза.
Протеин S, является активатором протеина C, синтезируется остеогенными клетками. Протеин S принимает участие в регулировании костного метаболизма, изменяя активность остеокластов.
Дефицит витамина К
Дефицит витамина К1 и К2 приводят к длительным кровотечениям и снижению минеральной плотности кости, что подтверждается удлинением протромбинового времени и увеличением доли недокарбоксилированных форм остеокальцина крови, соответственно.
Витамин К2 и остеопороз
Ряд исследований, проведенных на культуре клеток, показали, что витамин К2 оказывает анаболическое действие на костную ткань, стимулируя дифференцировку остеобластов и предотвращая образование остеокластов. Однако в исследованиях с участием людей не все так однозначно.
Было доказано, что потребление менее 100 мкг витамина К2 ассоциировано со снижением минеральной плотности костной ткани. Повышение недокарбоксилированных форм остеокальцина в сыворотке крови коррелирует с риском перелома шейки бедра и низкой минеральной плотностью бедренной кости у женщин в постменопаузе и пременопаузе. Однако позже стали появляться новые данные, показывающие, что дополнительный прием витамина К2 никак не влияет на плотность костной ткани у мужчин. Результаты самого большого и длительного исследования с использованием МК-4 доказали, что витамин оказывает положительное влияние только у женщин с запущенным остеопорозом.
Другая группа исследований, в котором изучались совместные влияния витамина К2 и витамина Д, продемонстрировала положительное влияние обоих витаминов на здоровье костей. Использование витаминов К2 и Д предотвращает потерю костной массы и снижает частоту переломов во всех случаях.
Витамин К2 и сердечно-сосудистые заболевания
Сердечно-сосудистые заболевания являются основной причиной смертности у людей старше 65 лет. Кальцификация коронарных артерий является показателем субклинических форм сердечно-сосудистых заболеваний и предсказывает появление инфаркта, инсульта в будущем. Витамин К2 подавляет кальцификацию сосудов с помощью белков GLa. Активация белков предотвращает осаждение кальция в стенке сосудов и хрящевой ткани.
В крупном исследовании, где принимали участие 4807 пациентов без инфаркта миокарда на начальном этапе, анализировались результаты потребления витамина К2 в течение 7 лет. Было показано значительное снижение риска ишемической болезни сердца, смертность от всех причин, тяжелой кальцификации аорты. В другом крупном исследовании с периодом наблюдения 8 лет было доказано, что увеличение потребления К2 на каждые 10 мкг способствует снижению коронарных событий на 9%.
Витамин К и углеводный обмен
Высказывается предположение о том, что добавка витамина К2 может улучшать состояние гликемического профиля и использоваться на определенном этапе терапии метаболических нарушений, включая сахарный диабет.
Недавнее исследование показало, что применение 30 мг витамина К2 повышает чувствительность тканей к инсулину у здоровых молодых людей посредством влияния на метаболизм остеокальцина. Плазменные уровни остеокальцина обратно пропорциональны уровню глюкозы натощак и через 2 часа после нагрузки. У женщин и мужчин с установленным диагнозом сахарный диабет, уровень остеокальцина обратно коррелировал с массой жировой ткани и уровнем гликированного гемоглобина.
К2 улучшает чувствительность к инсулину за счет вовлечения остеокальцина, зависимого от витамина К, противовоспалительных свойств и гиполипидемических эффектов.
Источник
ПРОТРОМБИН
ПРОТРОМБИН (син.: фактор II, тромбоген)— биосинтетический предшественник фермента тромбина в плазме крови.
П. является гликопротеидом с мол. весом (массой) 68 000—84 000. Полипептидная цепь П. состоит из 582 аминокислотных остатков; N-конце-вая аминокислотная последовательность П. человека: Ала—Асп—Тре— Фен—Лей—Глу—Глу (см. Аминокислоты). П., помимо аминокислот, содержит 10 остатков гамма-карбоксиглутаминовой к-ты, к-рая образуется при карбоксилировании глутаминовой к-ты на последней стадии биосинтеза. Модифицированная глутаминовая к-та в N-концевой части молекул белков протромбинового комплекса (протромбин, факторы VII, IX, X) обеспечивает их прочное связывание с ионами кальция и фосфолипидами, необходимыми для активации соответствующих проферментов.
П. осаждают из плазмы крови при 50—67% насыщении ее сульфатом аммония. П. высокой степени очистки получают путем ионообменной хроматографии на диэтиламиноэтилцеллюлозе (ДЭАЭ-целлюлозе). При фракционировании белков плазмы крови этиловым спиртом П. выделяют из остатков третьей фракции. П. адсорбируют из оксалатной плазмы сульфатом и карбонатом бария, гидроксидом алюминия или магния, а также фосфатом кальция.
Биосинтез П. происходит в печени и зависит от наличия витамина К. При измерении концентрации меченого П., введенного в кровоток больному с врожденной недостаточностью П., установлено, что период полураспада П. равен 60 час., при этом в кровяном русле содержится 43% П., а в периваскулярном пространстве — 57%.
В процессе образования тромбина (см.) из П., совершающегося в два этапа, происходит значительное укорочение полипептидной цепи молекулы П. Сначала протромбиназа, или протромбокиназа (фактор X в комплексе с фактором Vа, фосфолипидами и ионами кальция), расщепляет молекулу П., в результате чего образуется промежуточный продукт — претромбин II, который затем быстро расщепляется фактором Ха (активная форма фактора X) до тромбина, точнее а-тромбина, обладающего свертывающей активностью. а-Тромбин взаимодействует с молекулой П., и образуется неактивный претромбин I, который, в отличие от претромбина II, активируется медленно, т. к. лишен участков связывания с фосфолипидами. Т. о., структура N-концевой части молекулы П. способствует концентрированию П. на поверхности фосфолипидов, ориентации его с ферментом (фактором Xа) и регуляторным белком (фактором Vа), т. е. его активации.
В лабораторной и клин, практике применяют ряд методов определения П. в крови, из которых наиболее употребим метод Квика (см. Протромбиновое время). Истинный протромбин (фактор II) определяют двухступенчатым методом по Оврену: на первой стадии П. испытуемой плазмы активируется в тромбин, на второй — измеряется способность образовавшегося тромбина превращать стандартный р-р фибриногена в фибрин.
Дефицит П. можно определить с помощью ряда тестов, основанных на сравнении исследуемой плазмы с плазмой крови больных с заведомо известной недостаточностью протромбина и факторов V, VII, X. Существует также группа тестов для установления дефицита П., основанных на использовании змеиных ядов, которые обладают способностью превращать П. в тромбин без участия фактора Ха, фосфолипидов и ионов Са 2+ . Такими свойствами обладает яд австралийской змеи тайпан, песчаной эфы и др. Под влиянием этих ядов при дефиците П. и других факторов протромбинового комплекса удлиняется протромбиновое время (см.). Получили распространение методы определения П. с помощью хромогенных пептидных субстратов. Принцип их заключается в высокоточном определении амидазной активности тромбина, образующегося из П. исследуемой плазмы крови в присутствии активаторов, к-рыми могут служить тромбопластин и ионы Са 2+ или препараты, полученные из яда змей.
Содержание П. в плазме крови человека и разных видов животных колеблется от 7 до 17 мг/100мл. У человека наблюдаются также возрастные изменения концентрации П. в крови. Наиболее низкая концентрация П обнаружена у новорожденных в первые 3—4 дня их жизни; у детей грудного возраста она составляет в среднем 22, 2% от физиол, концентрации взрослого человека и превышает приблизительно в три раза содержание П., необходимое для нормального свертывания крови.
Низкое содержание П. в плазме крови (гипопротромбинемия) может быть генетически обусловленным и приобретенным. При наследственных гипопротромбинемиях наблюдают различные аномалии в строении молекулы П. Так, при истинной гипопротромбинемии (см. Геморрагические диатезы) отмечается нарушение биосинтеза П. и низкое его содержание в крови. Сродство аномальной молекулы П., к-рая образуется при этом, к ионам кальция гораздо ниже, чем в норме, и поэтому она неспособна превращаться в молекулу тромбина. Другой тип наследственной гипопротромбинемии характеризуется нормальным содержанием П., однако он при свертывании не превращается в активный фермент — тромбин. Приобретенные гипопротромбинемии могут развиться при передозировке антикоагулянтов непрямого действия (антагонистов витамина К), дефиците витамина К в организме, поражении печени.
Наследственные и приобретенные гипопротромбинемии приводят к тяжелым нарушениям системы гемостаза (см.). Клинически они выражаются кровоточивостью, тяжесть к-рой зависит от степени дефицита П.; спонтанные геморрагии резко выражены при концентрации протромбина 5% , а иногда 10—15% (норма 100% по Квику).
Библиография: Зубаиров Д. М. Биохимия свертывания крови, М., 1978, библиогр.; Кудряшов Б. А. Биологические проблемы регуляции жидкого состояния крови и ее свертывания, М., 1975; Проблемы и гипотезы в учении о свертывании крови, под ред. О. К. Гаврилова, М., 1981; С т р у к о в А. И. и С т р у к о-в а С. М. Структурно-функциональные основы гемостаза и его патология, Арх. патол., т. 42, № 9, с. 3, 1980, библиогр.; Струкова С. М. Молекулярные превращения протромбина в тромбин, Вестн. Моск. ун-та, Сер. 6 — Биология, почвоведение, JSfi 1, с. 17, 1976, библиогр.; Magnusson S. а. о. Complete primary structure of prothrombin, Cold Spr. Harb. Conf. on Cell Proliferation, p. 123, 1975; Suttie J. W. a. Jackson C. M. Prothrombin structure, activation, and byosynthesis, Physiol. Rev., v. 57, p. 1, 1977, bibliogr.; Walz D. A , Hewett-Emmett D. D. a. See-g e r s W. H. Amino acid sequence of human prothrombin fragments 1 and 2, Proc. nat. Acad. Sei. (Wash.), v. 74, p. 1969,
Источник
Для синтеза протромбина необходим витамин
а) Превращение протромбина в тромбин. При разрыве кровеносного сосуда или активации определенных веществ в крови сначала формируется активатор протромбина. В присутствии достаточного количества ионов кальция он вызывает превращение протромбина в тромбин (для облегчения понимания просим вас изучить рисунок ниже). В течение следующих 10-15 сек тромбин вызывает полимеризацию молекул фибриногена в нити фибрина. Таким образом, скорость развития свертывания крови обычно ограничивает образование активатора протромбина, а не последующие реакции, формирующие сам сгусток, поскольку в норме они осуществляются быстро.
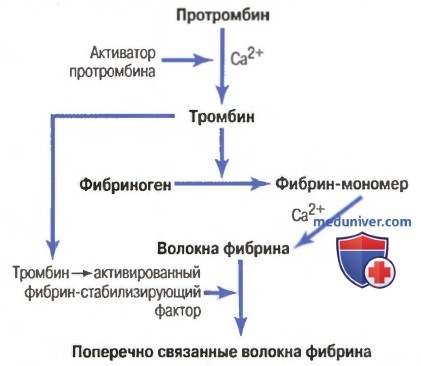
Важную роль в превращении протромбина в тромбин играют также тромбоциты в связи с прикреплением многих молекул протромбина к соответствующим рецепторам на тромбоцитах, уже связанных с поврежденной тканью.
Протромбин и тромбин. Протромбин представляет собой белок плазмы альфа2-глобулин с молекулярной массой 68700. Он присутствует в нормальной плазме в концентрации примерно 15 мг/дл. Это нестабильный белок, который легко расщепляется на более мелкие соединения, одно из которых — тромбин с молекулярной массой 33700, что составляет практически половину молекулярной массы протромбина.
Протромбин постоянно формируется печенью и постоянно используется в организме для свертывания крови. Если печень не способна синтезировать протромбин, примерно через сутки его концентрация в плазме снижается до значений, слишком низких для обеспечения нормального свертывания крови.
Для синтеза протромбина и некоторых других факторов свертывания печень нуждается в витамине К. Следовательно, недостаток этого витамина или болезнь печени, при которой нарушается нормальный синтез протромбина, могут привести к резкому снижению уровня протромбина, что проявляется склонностью к кровотечениям.
Превращение фибриногена в фибрин — формирование сгустка
а) Фибриноген. Фибриноген представляет собой высокомолекулярный белок (молекулярная масса 340000), концентрация которого в плазме составляет 100-700 мг/дл. Фибриноген образуется в печени, и при заболеваниях печени его концентрация в циркулирующей крови может снижаться, как и концентрация протромбина, о чем говорилось ранее.
В связи с большим размером молекулы фибриногена в норме практически не выходят из кровеносных сосудов в интерстициальную жидкость, и поскольку фибриноген является необходимым фактором свертывания, интер-стициальные жидкости обычно не свертываются. Однако при патологически повышенной проницаемости капилляров фибриноген вытекает в тканевые жидкости в достаточных количествах, чтобы вызвать свертывание в этих тканях практически тем же путем, как свертываются плазма и цельная кровь.
б) Формирование фибрина при действии тромбина на фибриноген. Тромбин является ферментом со слабой протеолитической способностью. Он действует на фибриноген, удаляя 4 низкомолекулярных пептида от каждой молекулы фибриногена, в результате формируются одиночные молекулы фибрин-мономеров, способные автоматически объединяться между собой с формированием нитей фибрина. Таким образом, молекулы фибрин-мономеров полимеризуются в длинные нити фибрина, составляющие основу сети кровяного сгустка.
На ранних этапах полимеризации молекулы мономеров фибрина удерживаются вместе с помощью слабых нековалентных водородных связей, и вновь формирующиеся волокна не скрепляются друг с другом поперечными связями; в результате сгусток получается слабым и легко «рассыпается» на отдельные нити. Однако в течение нескольких следующих минут осуществляется другой процесс, значительно укрепляющий сеть фибрина. Этот процесс требует участия особого вещества, называемого фибрин-стабилизирующим фактором. Небольшое количество этого фактора присутствует в крови в норме среди плазменных глобулинов, но он также высвобождается из тромбоцитов, захваченных в тромб.
На волокна фибрина фибрин-стабилизирующий фактор> влияет лишь после его активации, которая осуществляется под влиянием того же тромбина, вызывающего образование фибрина. Затем активированный фибрин-стабилизирующий фактор действует как фермент, который вызывает ковалентное связывание все большего числа молекул фибрин-мономера, а также многочисленное поперечное связывание прилежащих волокон фибрина, чрезвычайно усиливая трехмерную структуру их сети.
в) Кровяной сгусток. Сгусток состоит из сети сложно переплетенных волокон фибрина и захваченных в эту сеть клеток крови, тромбоцитов и плазмы. Волокна фибрина также прикрепляются к пораженным поверхностям кровеносных сосудов; следовательно, кровяной сгусток крепится к любому отверстию сосуда, предупреждая дальнейшую потерю крови.
г) Ретракция сгустка. Сыворотка. Через несколько минут после формирования сгусток начинает сокращаться, и обычно в течение 20-60 мин из него выжимается основная часть жидкости. Эту жидкость называют сывороткой, поскольку в ней отсутствуют фибриноген и большинство других факторов свертывания. В связи с потерей этих факторов сыворотка в отличие от плазмы не может свертываться.
Для ретракции сгустка необходимы кровяные пластинки. Следовательно, отсутствие ретракции сгустка может быть показателем низкого количества тромбоцитов в циркулирующей крови. Электронные микрофотографии кровяных сгустков показывают, что тромбоциты в них прикрепляются к волокнам фибрина, фактически связывая разные волокна вместе.
Более того, тромбоциты, захваченные в сгусток, продолжают выделять прокоагулянтные вещества, среди которых одним из наиболее важных является фибрин-стабилизирующий фактор, вызывающий образование все большего количества поперечных связей между прилежащими волокнами фибрина.
Кроме того, тромбоциты сами непосредственно участвуют в сокращении сгустка путем активации молекул тромбостени-на, актина и миозина, т.е. сократительных белков кровяных пластинок. В результате происходит мощное сокращение тромбоцитарных выростов, прикрепленных к волокнам, помогая сжимать сеть фибрина до еще меньшего объема. Сокращение активируется и ускоряется тромбином, а также ионами кальция, которые выделяются из кальциевых депо в митохондриях, эндоплазматическом ретикулуме и аппарате Гольджи тромбоцитов.
В результате ретракции сгустка концы разорванного кровеносного сосуда стягиваются вместе, что служит важным фактором, способствующим завершению гемостаза.
д) Порочный круг при формировании сгустка. Сразу после начала формирования сгустка он распространяется в течение нескольких минут на окружающую кровь. Это значит, что сам сгусток инициирует порочный круг (положительную обратную связь), способствуя дальнейшему развитию свертывания, поскольку протеолитическое действие тромбина позволяет ему действовать на многие другие свертывающие факторы, кроме фибриногена.
Например, тромбин оказывает прямое протеолитическое действие на протромбин, способствуя превращению его в еще большее количество тромбина. Кроме того, тромбин действует на некоторые из факторов свертывания крови, ответственные за образование активатора протромбина. (Эти эффекты, изложенные в следующих статьях на сайте, включают ускорение действия факторов VIII, IX, X, XI и XII, а также агрегацию тромбоцитов.) Сразу после образования критического количества тромбина развивается порочный круг, который ведет к еще большему свертыванию крови, в результате формируется все больше тромбина; таким образом, кровяной сгусток продолжает расти до тех пор, пока не прекратится кровотечение.
Видео физиология остановки кровотечения (гемостаза) — профессор, д.м.н. П.Е. Умрюхин
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
