Биосинтез гемоглобина
Учитывая, что белковая часть молекулы гемоглобина (глобин) синтезируется, как и все остальные белки, далее подробно рассмотрен биосинтез его простетической группы, т.е. синтез тетрапиррольного соединения – гема (см. главу 2).
К настоящему времени почти полностью выяснены основные пути образования порфиринов и протопорфиринов, являющихся непосредственными предшественниками гема и хлорофилла. Благодаря исследованиям Д. Шемина и др. выяснены основные пути синтеза гема. С помощью меченых предшественников было показано, что в синтезе гема в бесклеточных экстрактах эритроцитов птиц специфическое участие принимают глицин, уксусная и янтарная кислоты. Источником всех 4 атомов азота и 8 атомов углерода тетрапиррольного кольца оказался глицин, а источником остальных 26 из 34 атомов углерода – янтарная кислота (сук-цинат), точнее ее производное сукцинил-КоА. Последовательность химических реакций синтеза тетрапирролов в организме животных можно условно разделить на несколько стадий.
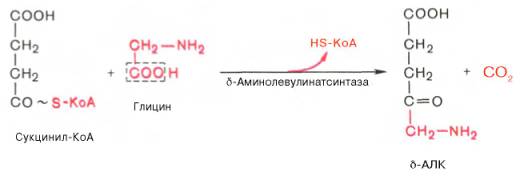
На I стадии, протекающей в 2 этапа, сукцинил-КоА взаимодействует с глицином и образованием δ-аминолевулиновой кислоты (δ-АЛК).
Эту стадию катализирует специфический пиридоксальфосфатзависимый фермент δ-аминолевулинатсинтаза – ключевой, аллостерический фермент синтеза тетрапирролов.
Впервые эта синтаза была обнаружена в эндоплазматической сети клеток печени. Фермент индуцируется стероидами и другими факторами и ингибируется по типу обратной связи конечным продуктом биосинтеза – гемом.
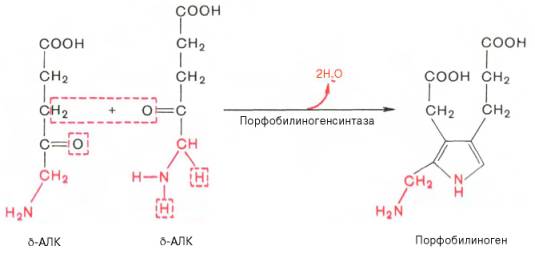
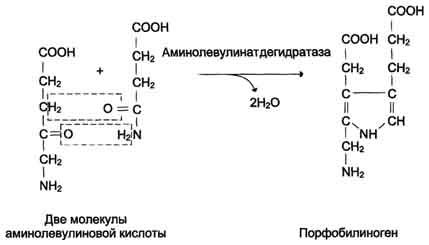
На II стадии происходит конденсация 2 молекул δ-аминолевулиновой кислоты с образованием первого монопиррольного соединения – порфо-билиногена (ПБГ).
Фермент, катализирующий эту стадию,– порфобилиногенсинтаза также является регуляторным ферментом, подвергаясь ингибированию конечными продуктами синтеза. Предполагают, что механизм этой сложной реакции дегидратации включает образование кетиминной связи (шиффово основание) между кетогруппой одной молекулы δ-аминолевулиновой кислоты и δ-аминогруппой лизина молекулы фермента. В следующей многоступенчатой стадии, катализируемой соответствующими ферментами, из 4 монопиррольных молекул порфобилиногена синтезируется тетра-пиррольный комплекс протопорфирин IX, являющийся непосредственным предшественником гема. Некоторые этапы сложного пути синтеза окончательно не установлены.
В заключительной стадии протопорфирин IX присоединяет молекулу железа при участии феррохелатазы (гемсинтазы), и образуется гем. Последний используется для биосинтеза всех гемсодержащих хромопро-теинов.
Источником железа для этой реакции является ферритин, который считается резервным гемопротеином, откладывающимся в клетках костного мозга, печени и селезенки.
Имеются указания, что, помимо железа, в синтезе гема участвуют некоторые кофакторы, в частности витамин В12, ионы меди, хотя конкретная их роль не раскрыта.
Таким образом, весь путь синтеза гема может быть представлен в виде схемы, в которой даны полные и сокращенные обозначения промежуточных метаболитов и ферментов.
Источник
Витамины и микроэлементы, участвующие в регуляции системы кроветворения (Fe, Ca, Mg, Co, Cu, Zn, Mo, витамины B9, B12, K, B6, B5, D, E, омега-3, омега-6 жирные кислоты)
Комплексный анализ основных витаминов и микроэлементов, необходимых для нормального гемопоэза, используемый для диагностики заболеваний крови, в том числе анемии.
Основные микронутриенты гемопоэза, дефицит микронутриентов при анемии, анализы при анемии.
Hemopoiesis, vitamins and trace elements, Micronutrients in anemia, Nutrient status in anemia.
Высокоэффективная жидкостная хроматография.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 8 часов до исследования, можно пить чистую негазированную воду.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Гемопоэз – комплексный процесс, включающий формирование и последовательное созревание клеток трех основных гемопоэтических ростков (эритроцитов, лейкоцитов и тромбоцитов). В норме у взрослого человека и ребенка функцию кроветворения выполняет красный костный мозг, сосредоточенный преимущественно в плоских костях и эпифизах трубчатых костей. Часть соединений, необходимых для гемопоэза, человеческий организм способен вырабатывать самостоятельно (АТФ, глицин, фосфолипиды). Однако значительную роль в процессе гемопоэза играют соединения, которые в естественных условиях организмом не синтезируются, – витамины и микроэлементы. Их поступление полностью зависит от качества питания.
Организации, занимающиеся разработкой рекомендаций по диетологии, периодически пересматривают и публикуют рекомендованные суточные нормы потребления витаминов и микроэлементов, рассчитанные для среднестатистического здорового человека определенной возрастной группы. Так, например, норма железа составляет 11 мг/сутки для младенца женского или мужского пола, 8 мг/сутки – для взрослого мужчины и 18 мг – для взрослой женщины, а беременные женщины должны получать не менее 27 мг железа в сутки. Дефицит или, наоборот, избыток этих соединений может оказывать негативное влияние на процесс гемопоэза.
Наибольшее клиническое значение имеет анемия, обусловленная дефицитом железа, фолиевой кислоты (витамин В9), витамина В12 (цианокобаламин) и В6 (пиридоксаль-5-фосфат). Несмотря на разную этиологию, различные формы анемии, однако, имеют схожую симптоматику в виде повышенной утомляемости, одышки и учащенного сердцебиения. По этой причине диагностика анемий и других нарушений кроветворения носит комплексный характер. Очень информативным является комплексное исследование, включающее витамины и микроэлементы, нарушение метаболизма которых может быть причиной заболевания.
Железо и витамин B6 необходимы для синтеза гема молекулы гемоглобина, а их дефицит приводит к нарушению созревания эритроцитов. Железодефицитная анемия (ЖА) – это самая частая форма анемии как среди взрослого населения, так и у детей. Причинами ЖА могут быть алиментарный дефицит железа (например, вегетарианство), кровопотеря (например, обильные менструации, частые носовые кровотечения), хроническое кровотечение пищеварительного тракта (язвенная болезнь желудка, геморрой), инфекционные заболевания (глистные инвазии), заболевания тонкой кишки (целиакия) и прием лекарственных средств (холестирамин, омепразол), затрудняющие всасывание железа. ЖА можно заподозрить при выявлении у пациента микроцитарной (MCV менее 80 мкм 3 ) анемии, а также некоторых других клинико-лабораторных характеристик крови: анизоцитоза (увеличение RDW) и гипохромии эритроцитов, а также тромбоцитоза.
Изолированный дефицит витамина В6 встречается достаточно редко, однако он является распространенным осложнением лечения изониазидом, циклосерином и пеницилламином. Клинико-лабораторные признаки анемии, обусловленной дефицитом витамина В6, напоминают таковые при железодефицитной анемии – характерны микроцитоз и гипохромия, – показатели обмена железа при этом, однако, в норме.
Другой причиной анемии является дефицит витаминов B12 (цианокобаламина) и B9 (фолиевой кислоты). Эти витамины необходимы для нормального синтеза ДНК и последующего деления клеток. Их дефицит приводит к развитию макроцитарной анемии (MCV более 100). Клинические и лабораторные изменения, наблюдаемые при дефиците фолиевой кислоты и витамина В12, очень похожи друг на друга, поэтому чаще эти формы анемии рассматривают вместе. Причинами дефицита В12 могут являться веганская диета, заболевания поджелудочной железы (хронический панкреатит), желудка (атрофический гастрит) и подвздошной кишки (болезнь Крона), препятствующие нормальному всасыванию этого витамина, и редко дифиллоботриоз,; причинами дефицита фолиевой кислоты — хронический алкоголизм, беременность, применение некоторых лекарственных препаратов (метотрексат, триметоприм, фенитоин). В отличие от других макроцитарных анемий, обусловленных, например, гипотиреозом, анемия, вызванная дефицитом витамина В12 или фолиевой кислоты, также является мегалобластической анемией – то есть в мазке крови наблюдаются гиперсегментированные нейтрофилы и ядросодержащие эритроциты.
Железо, фолиевая кислота и витамины В12 и В6 являются ключевыми компонентами кроветворения. Роль других микронутриетов также важна, однако не является определяющей. Так, например:
- кальций участвует в переключении кроветворения с печеночного на костномозговое, что происходит после рождения;
- медь выступает в роли кофактора фермента, окисляющего ионы железа до двухвалентного состояния Fe 2+ — именно в окисленной форме железо связывается с белком-переносчиком трансферрином и попадает в костный мозг;
- витамин Е (токоферол) препятствует воздействию оксидативного стресса на мембраны эритроцитов;
- омега-3 и омега-6 жирные кислоты регулируют пролиферацию клеток миелоидного ростка.
Дефицит этих, а также некоторых других микронутриентов может сопровождаться нарушением кроветворения.
Таким образом, к нарушению кроветворения, и в первую очередь к анемии, может приводить дефицит достаточно широкого спектра соединений. Комплексное исследование позволяет заподозрить причину заболевания. В некоторых случаях, однако, могут потребоваться дополнительные исследования, в том числе морфологическое исследование костного мозга.
Для чего используется исследование?
- Для диагностики заболеваний крови, в первую очередь анемии.
Когда назначается исследование?
- При наличии симптомов анемии: повышенной утомляемости, одышки, учащенного сердцебиения.
- При наличии факторов риска анемии: хронического кровотечения ЖКТ, обильных менструаций, хронических инфекционно-воспалительных заболеваний (глистные инвазии, туберкулез), приема некоторых лекарственных средств (омепразол, фенитоин, метотрексат), хронического алкоголизма и др.
- При обнаружении у пациента лабораторных признаков анемии (снижения уровня эритроцитов и/или гемоглобина).
Что означают результаты?
Магний: 12.15 — 31.59 мг/л
Железо: 270.00 — 2930.00 мкг/л
Цинк: 650.00 — 2910.00 мкг/л
Витамин В5 (пантотеновая кислота): 0.2 — 1.8 мкг/мл
Витамин D, 25-гидрокси (кальциферол): 3.0 — 49.6 нг/мл
Витамин К (филлохинон): 0.1 — 2.2 нг/мл
Кобальт: 0.10 — 0.40 мкг/л
Кальций: 86.00 — 102.00 мг/л
Молибден: 0.10 — 3.00 мкг/л
Медь: 575.00 — 1725.00 мкг/л
Хром: 0.05 — 2.10 мкг/л
Витамин Е: 5.00 — 18.00 мкг/мл
Витамин B9 (фолиевая кислота): 2.5 — 15.0 нг/мл
Витамин В12 (цианокобаламин): 189.0 — 833.0 пг/мл
Витамин В6 (пиридоксаль-5-фосфат): 8.70 — 27.20 нг/мл
Причины понижения показателей:
- алиментарный дефицит (вегетарианство, веганские диеты);
- период активного роста (подростки), беременность, лактация;
- заболевания кишечника, препятствующие нормальному всасыванию витаминов/микроэлементов (целиакия, болезнь Крона);
- хронический алкоголизм;
- прием некоторых лекарственных препаратов (фенитоин, пероральные контрацептивы, метотрексат, триметоприм и другие);
- наследственные нарушения метаболизма.
Причины повышения показателей:
- гемохроматоз (избыток железа);
- гиперпаратиреоз, злокачественные заболевания, саркоидоз, длительная иммобилизация (избыток кальция);
- гипервитаминоз витаминов D и E.
Что может влиять на результат?
- Возраст;
- характер питания;
- физиологическое состояние организма (беременность, лактация, реконвалесценция, интенсивные физические нагрузки);
- прием лекарственных препаратов;
- наличие сопутствующих заболеваний.
Кто назначает исследование?
Терапевт, врач общей практики, педиатр, гематолог.
Литература
- Varney ME, Buchanan JT, Dementieva Y, Hardman WE, Sollars VE. A high omega-3 fatty acid diet has different effects on early and late stage myeloid progenitors. Lipids. 2011 Jan;46(1):47-57. doi: 10.1007/s11745-010-3491-3. Epub 2010 Oct 31.
- Fauci et al. Harrison’s Principles of Internal Medicine/A. Fauci, D. Kasper, D. Longo, E. Braunwald, S. Hauser, J. L. Jameson, J. Loscalzo; 17 ed. — The McGraw-Hill Companies, 2008.
Источник
94. Синтез гема и гемоглобина. Регуляция этих процессов. Вариации первичной структуры и свойств гемоглобина. Гемоглобинопатии.
Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени (рис. 13-2). В костном мозге гем необходим для синтеза гемоглобина в ретикулоцитах, в гепатоцитах — для образования цитохрома Р450.
Первая реакция синтеза гема — образование 5-аминолевулиновой кислоты из глицина и сук-цинил-КоА (рис. 13-3) идёт в матриксе митохондрий, где в ЦТК образуется один из субстратов этой реакции — сукцинил-КоА. Эту реакцию катализирует пиридоксальзависимый фермент аминолевулинатсинтаза.
Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму. В цитоплазме проходят промежуточные этапы синтеза гема: соединение 2 молекул 5-аминолевулиновой кислоты молекулу порфобилиногена (рис. 13-4), дезаминированиепорфобилиногена с образованием гидроксиметилбилана, ферментативное превращение гидроксиметилбилана в молекулу уропор-фобилиногена III, декарбоксилирование последнего с образованием копропорфириногена III. Гидроксиметилбилан может также нефермента-тивно превращаться в уропорфириноген I, который декарбоксилируется в копропорфирино-ген I. Из цитоплазмы копропорфириноген III опять поступает в митохондрии, где проходят заключительные реакции синтеза гема. В результате двух последовательных окислительных реакций копропорфириноген III превращается в протопорфириноген IX, а протопорфириноген IX — в Протопорфирин IX. Фермент феррохела-таза, присоединяя к протопорфирину IX двухвалентноелентное железо, превращает его в гем (рис. 13-2). Источником железа для синтеза гема служит депонирующий железо белок ферритин. Синтезированный гем, соединяясь с α и β-полипепептидными цепями глобина, образует гемоглобин. Гем регулирует синтез глобина: при снижении скорости синтеза гема синтез глобина в ретикулоцитах тормозится.
Донором железа служит депонирующий железо в клетках белок ферритин.
Рис. 13-3. Реакция образования 5-аминолевулиновой кислоты.
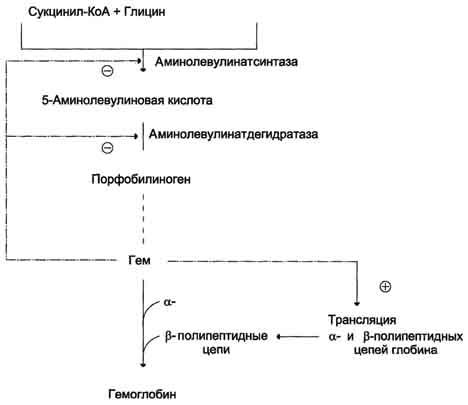
Регуляция биосинтеза гема
Регуляторную реакцию синтеза гема катализирует пиридоксальзависимый фермент аминолевулинатсинтаза. Скорость реакции регулируется аллостерически и на уровне трансляции фермента.
Аллостерическим ингибитором и корепрессором синтеза аминолевулинатсинтазы является гем (рис. 13-5).
В ретикулоцитах синтез этого фермента на этапе трансляции регулирует железо. На участке инициации мРНК, кодирующей фермент, имеется последовательность нуклеотидов, образующая шпилечную петлю, которая называется железочувствительным элементом (от англ, iron-responsiveelement, IRE) (рис. 13-6).
Рис. 13-5. Регуляция синтеза гема и гемоглобина. Гем по принципу отрицательной обратной связи ингибирует аминолевулинатсинтазу и аминолевулинатдегидратазу и является индуктором трансляции α- и β-цепей гемоглобина.
При высоких концентрациях железа в клетках оно образует комплекс с остатками цистеина регуляторного железосвязывающего белка. Взаимодействие железа с регуляторным железосвязывающим белком вызывает снижение сродства этого белка к IRE-элементу мРНК, кодирующей аминолевулинатсинтазу, и продолжение трансляции (рис. 13-6, А). При низких концентрациях железа железосвязывающий белок присоединяется к железо-чувствительному элементу, находящемуся на 5′-нетранслируемом конце мРНК, и трансляция аминолевулинатсинтазы тормозится (рис. 13-6, Б).
Аминолевулинатдегидратаза также аллостерически ингибируется гемом, но так как активность этого фермента почти в 80 раз превышает активность аминолевулинатсинтазы, то это не имеет большого физиологического значения.
Дефицит пиридоксальфосфата и лекарственные препараты, которые являются его структурными аналогами, снижают активность аминолевулинатсинтазы.
Альфа-полипептидная цепь заканчивается комбинацией аминокислот валина-лейцина, а бета-полипептидная цепь — комбинацией валина-гистидина-лейцина. Альфа- и бета-полипептидные цепи в гемоглобиновой молекуле не размещены линейно, как это выглядит на первый взгляд из данных,это первичная структура .
Гемоглобинопатии группа наследственных гемолитических анемий, обусловленных нарушениями первичной структуры гемоглобина (качественные гемоглобинопатии) или синтеза глобиновых цепей (количественные гемоглобинопатии).
Источник