Катаболизм аминокислот начинается с дезаминирования
У человека основным способом дезаминирования является окислительное дезаминирование . Выделяют два варианта окислительного дезаминирования: прямое и непрямое.
Прямое окислительное дезаминирование
Прямое дезаминирование катализируется одним ферментом, в результате образуется NH3 и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода ( аэробное ) и не нуждаться в кислороде ( анаэробное ).
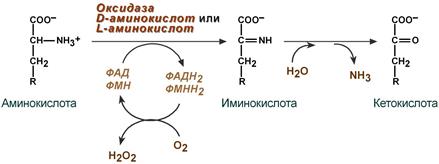
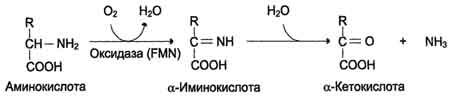
1. Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН.
Реакция, катализируемая оксидазами D- и L-аминокислот
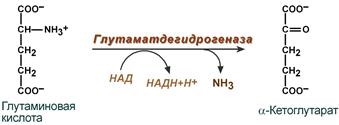
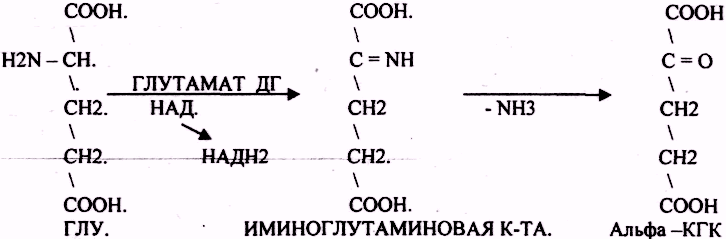
2. Анаэробное прямое окислительное дезаминирование существует только для глутаминовой кислоты, катализируется только глутаматдегидрогеназой , превращающей глутамат в α-кетоглутарат. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных). Этот тип дезаминирования теснейшим образом связан с трансаминированием аминокислот и формирует с ним процесс трансдезаминирования (см ниже).
Реакция прямого окислительного дезаминирования
глутаминовой кислоты
В печени реакция используется для получения аммиака из его транспортной формы глутаминовой кислоты. Далее аммиак входит в реакции синтеза мочевины.
Непрямое окислительное дезаминирование (трансдезаминирование)
Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
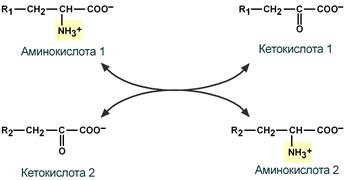
Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты при участии ферментов аминотрансфераз. Этот перенос называется трансаминирование и его механизм довольно сложен.
В качестве конечной кетокислоты-акцептора («кетокислота 2») в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат («аминокислота 2»).
Схема реакции трансаминирования
В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О.
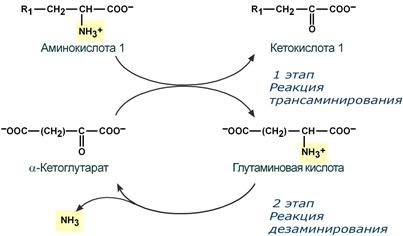
Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование .
Т.к. в организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота , то только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Этот этап осуществляется глутаматдегидрогеназой (перейти вверх к ее реакции), которая имеется в митохондриях всех клеток организма, кроме мышечных.
Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование .
Схема обоих этапов трансдезаминирования
Если реакция прямого дезаминирования идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза.
Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН.
Роль трансаминирования и трансдезаминирования
- активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения,
- обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога),
- начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии,
- необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования безазотистого остатка аминокислот в печени для кетогенеза и глюконеогенеза, в других органах – для его прямого вовлечения в реакции цикла трикарбоновых кислот.
При патологиях (сахарный диабет 1 типа, гиперкортицизм) реакции трансаминирования обусловливают появление субстратов для глюконеогенеза и способствуют патологической гипергликемии.
Продукт трансаминирования глутаминовая кислота:
- является одной из транспортных форм аминного азота в гепатоциты,
- способна реагировать со свободным аммиаком, обезвреживая его (синтез глутамина).
Процесс трансдезаминирования идет в организме непрерывно, потому что:
- сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей.
Источник
27. Дезаминирование аминокислот. Виды дезаминирования. Окислительное дезаминирование. Непрямое дезаминирование аминокислот на примере тирозина.
ДЕЗАМИНИРОВАНИе — разрушение NН2-группы с выделением аммиака. В организме возможны следующие виды:
Эти три вида ДЕЗАМИНИРОВАНИЯ имеют место при гниении.
4. Окислительное. ОКИСЛИТЕЛЬНОМУ ДЕЗАМИНИРОВАНИЮ подвергается только ГЛУ.
ОКИСЛИТЕЛЬНОМУ ДЕЗАМИНИРОВАНИЮ подвергаются и другие аминокислоты, но этот путь является непрямым. Он идёт через ГЛУ и называется процессом НЕПРЯМОГО ОКИСЛИТЕЛЬНОГО ДЕЗАМИНИРОВАНИЯ.
28. Синтез мочевины (орнитиновый цикл), последовательность реакций. Биологическая роль.
Синтез мочевины — основной путь обезвреживания аммиака — ОРНИТИНОВЫЙ ЦИКЛ.
Образование мочевины идёт только в печени. Две первые реакции цикла (образование ЦИТРУЛЛИНА и АРГИНИНОСУКЦИНАТА) идут в МИТОХОНДРИЯХ, остальные в цитоплазме. В организме в сутки образуется 25гр мочевины. Этот показатель характеризует мочевино- образующую функцию печени. Мочевина из печени поступает в почки, где и выводится из организма как конечный продукт азотистого обмена.
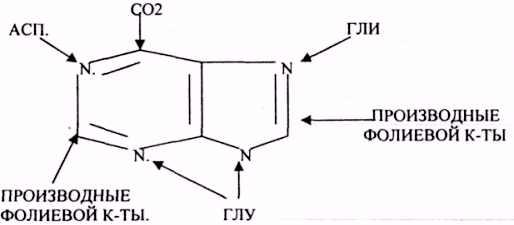
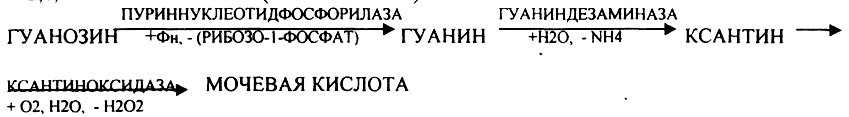
29. Особенности обмена пуриновых нуклеотидов. Их строение и распад. Образование мочевой кислоты. Подагра.
Для биосинтеза ПУРИНОВЫХ оснований доносами атомов и атомных групп являются:
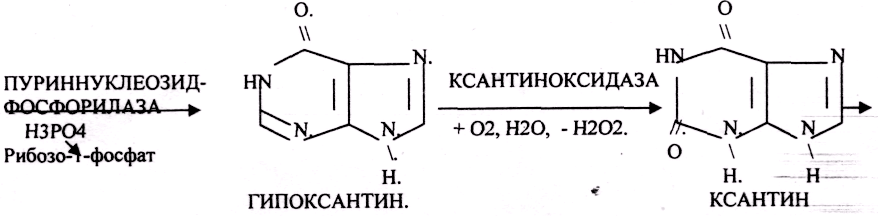
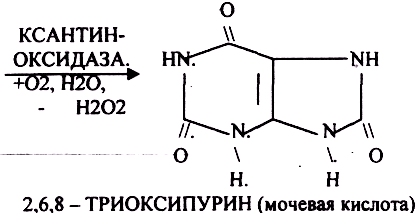
Окисление мочевой кислоты — окисление ПУРИНОВЫХ НУКЛЕОЗИДОВ.
Мочевая кислота является конечным продуктом распада ПУРИНОВЫХ НУКЛ.
Уровень мочевой кислоты свидетельствует об интенсивности распада ПУРИНОВЫХ оснований тканей организма и пищи.
НАРУШЕНИЕ ОБМЕНА НУКЛЕОТИДОВ. ГИПЕРУРИКЕМИЯ — повышение уровня мочевой кислоты в крови указывает на повышенный распад нуклеиновых кислот или пуриновых нуклеотидов.(подагру). Заболевание генетически детерминировано и носит семейный характер. При подагре кристаллы мочевой кислоты откладываются в суставных хрящах, синовиальной оболочке, клетчатке. Развивается тяжелый острый механический подагрический артрит и нефропатии.
30.Генетический код
Генетический код и его свойства.
Генетический код – способ записи информации об А-К последовательности нуклеотидов в ДНК или РНК.
Триплетность – 3 нуклеотидных остатка кодируют 1 АК
Квазидуплетность – информацию об АК несут первые 2 нуклеотида в кодоне, а 3 малозначим
Однозначность – каждый триплет кодирует только 1 АК
Вырожденность – свойство ген. Кода, при которомодну и ту же АК могут кодировать несколько триплетов
Универсальность – свойство в том, что генетический код одинаков почти у всех видов организмов
Линейность – информация заключается в зрелой мРНК, в процессе трансляции считывается последовательно, строго в определенном направлении без остановок
Коллинеарность – соответствие последовательности кодонов в зрелой мРНК последовательности АК в синтезируемом белке
Современные представления о структурно-функциональной организации ДНК: генная (структурные, регуляторные элементы ДНК) и негенная (тандемные повторы, псевдогены, мобильные элементы ДНК) области.Основные направления молекулярной биологии (OMICS): геномика, транскриптомика, РН-омика .
95% ДНК человека представляет негенная часть. 5% — собственно гены.
ФУНКЦИОНАЛЬНЫЕ ЭЛЕМЕНТЫ ГЕНОМА:
1. СТРУКТУРНЫЕ ГЕНЫ
2. РЕГУЛЯТОРНЫЕ ЭЛЕМЕНТЫ
Структурные гены кодируют синтез МРНК, ТРНК, РРНК. Регуляторные элементы не кодируют РНК и, соответственно, белков; влияют на работу
Не генная часть представлена:
1. ТАНДЕМНЫЕ ПОВТОРЫ монотонные повторы НУКЛЕОТИДОВ, не имеющие смысла. Это так называемые «пустынные участки» ДНК. В настоящее время смысл этих участков: выполнение структурной функции и площадки для образования генов в эволюции (эволюционный резерв).
2. ПСЕВДОГЕНЫ — неактивные, но стабильные генетические элементы, возникающие в результате мутации в ранее работавших генах (гены, выключенные мутацией). Это побочный продукт и генетический резерв эволюции. Составляют 20 — 30% не генной части ДНК.
3. Мобильные генетические элементы:
-ТРАНСПОЗОНЫ — участки ДНК, способные вырезаться и встраиваться в другие области
ДНК. Это так называемые «странники генов».
-РЕТРОТРАНСПОЗОНЫ — участки ДНК, копирующиеся в пределах генома, как внутри
хромосомы, так и между ними. Могут изменять смысл структурных генов человека, приводят к мутациям. Геном человека изменяется в течении жизни на 10 — 30%.
— поврежденные неактивные, мобильные генетические элементы. Не могут ни вырезаться, ни встраиваться из-за отсутствия в клетке ОБРАТНОЙ ТРАНСФЕРАЗЫ. Если фрагмент поступает в клетку с вирусом, то тогда эти гены начинают транскрибироваться.
Основные направления молекулярной биологии:
ГЕНОМИКА — отрасль молекулярной биологии, изучающая структуру и механизмы работы гена.
Транскриптомика – изуение и идентификация всех мРНК, кодирующих белки, изучение их количества и закономерностей экспрессии структурных генов.
РН-омика – раздел молекулярной биологии, занимающийся изучением и идентификацией всех некодирующих РНК
Источник
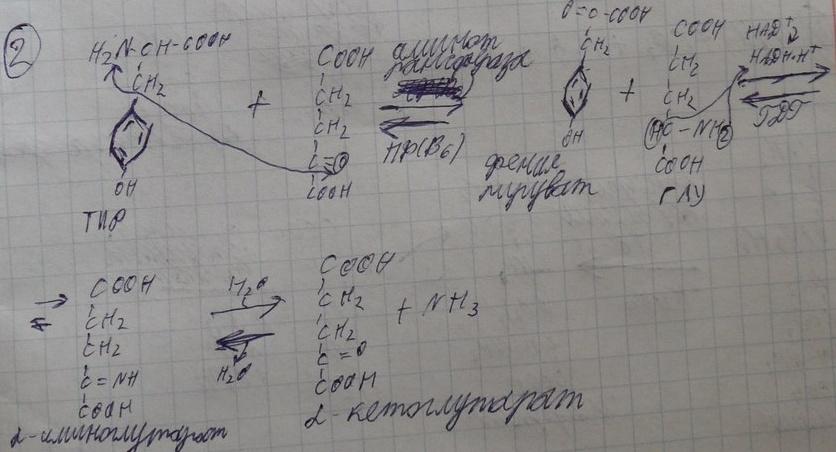
21)Непрямое дезаминирование , транс-дезаминирование, химизм, биологическая роль
Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования:
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD + ).
Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование — основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы (рис. 9-9), что обеспечивает как катаболизм аминокислот (рис. 9-9, А), так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты (рис. 9-9, Б).
В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Вначале происходит перенос аминогруппы аминокислот на аспартат, затем на инозиновую кислоту (ИМФ) и в завершение — дезаминирование АМФ. Представленная схема отражает последовательность реакций непрямого неокислительного дезаминирования:
Можно выделить 4 стадии процесса:
трансаминирование с α-кетоглутаратом, образование глутамата;
трансаминирование глутамата с оксалоацета-том (фермент ACT), образование аспартата;
реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
гидролитическое дезаминирование АМФ.
Перенос аминогруппы от аспартата и синтез АМФ происходят следующим образом (см. схему А на с. 476).
Реакция дезаминирования адениловой кислоты происходит под действием фермента АМФ дезаминазы (см. схему Б на с. 476).
Рис. 9-8. Биологическая роль оксидазы D-аминокислот.
Рис. 9-9. Биологическая роль непрямого дезаминирования. А — при катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогена-зы, в результате чего получаются а-кетоглутарат и аммиак; Б — при необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты.
Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
22)Декарбоксилирование аминокислот.Процесс отщепления карбоксильной группы ак в виде СО2 и приводит к образованию биогенных аминов, которые оказывают фармакологическое действие на физиологические функции человека.
Серотонин обладает сосудосуживающим действием, участвует в регуляции артериального давления, t тела, дыхания, медиатор нервных процессов.
Дофамин- предшественник катехоламинов.
Гистамин обладает сосудорасширяющим действием. Он образуется в области воспаления, участвует в развитии аллергических реакций.
глутамат NH2 NH2 γ аминомасляная кислота (ГАМК)
ГАМК является тормозным медиатором. В лечебной практике используется при лечении эпилепсии (резкое сокращение частоты припадков).
Орнитин декарбоксилируясь дает диамин – путресцин, а лизин – кадаверин.
Источник