Комбинированный дефицит витамин K-зависимых факторов свертывания крови
OMIM 607473
Наша команда профессионалов ответит на ваши вопросы
Ген VKORC1 (OMIM: *608547) расположен на коротком плече 16 хромосомы, кодирует субъединицу 1 комплекса эпоксид-редуктазы витамина K. Это мембранный протеин, состоящий из одной пептидной цепи, состоящей из 163 аминокислотных остатков, тесно связанный с эндоплазматическим ретикулумом. Этот фермент переводит неактивную (окисленную) форму витамина K, поступающую в организм, в активную (редуцированную) форму, участвующие в пострансляционном карбоксилировании витамин K-зависимых белков. Витамин K включает в себя группу жирорастворимых витаминов, которые необходимы для посттрансляционной модификации белков, большинство которых является белками свертывающей и противосвертывающей системы крови (протромбин (фактор II), факторы VII, IX, X, протеины C, S и Z). Недостаток всех витамин-К-зависимых факторов свертывания крови может вызываться как нарушениями всасывания/транспорта витамина К, что устраняется его оральным приемом, так и мутациями в генах, кодирующих белки цикла превращения витамина К, в том числе гена VKORC1.
Комбинированный дефицит витамин-К-зависимых факторов свертывания крови (OMIM: #607473 ) — редкое заболевание с аутосомно-рецессивным типом наследования, вызываемое мутациями в гене VKORC1, клинически проявляется частыми случаями кровоизлияния в мозг в первые годы жизни, иногда приводящими к гибели ребенка.
В Центре Молекулярной Генетики проводится исследование нуклеотидной последовательности 1, 2, 3 экзонов гена VKORC1 методом прямого автоматического секвенирования.
Источник
Дефицит витамин к-зависимых факторов коагуляции
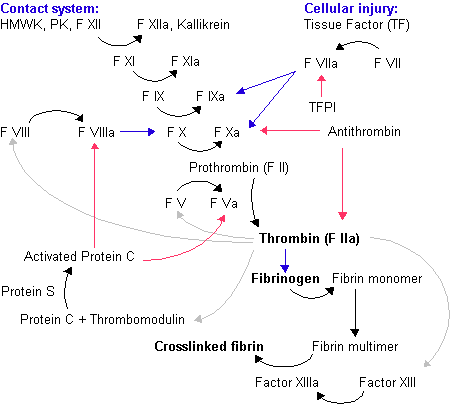
Синтез плазменных факторов свертывания крови в печени (протромбин, факторы VII, IX, X, протеины С и S) зависит от уровня витамина К. Содержащийся в пище витамин К всасывается в тонкой кишке и накапливается в печени. В микросомах печени он превращается в активный эпоксид, который служит кофактором ферментативного карбоксилирования остатков глутаминовой кислоты в молекулах факторов протромбинового комплекса (рис. 5. ) Нарушения обмена витамина К (пищевой дефицит, нарушения всасывания, обструкция желчных путей) приводят к уменьшению выработки этих факторов и их концентрации в плазме крови.
Рисунок 5. Метаболизм витамина К. В процессе -карбоксилирования остатков глутаминовой кислоты в молекулах факторов свертывания витамин К в микросомах печени превращается в активный эпоксид, который вновь восстанавливается в исходное состояние витамин-К-эпоксиредуктазой мембраны гепатоцитов. Варфирин конкурентно ингибирует действие витамина К, блокируя действие этого фермента.
Наиболее часто дефицит витамина К развивается у тяжелых больных с нарушениями питания, особенно на фоне лечения медикаментами, которые являются фармакологическими антагонистами витамина (непрямые антикоагулянты) или угнетают кишечную флору (антибиотики широкого спектра действия, сульфаниламиды).
Простым и доступным методом диагностики дефицита витамина К и контроля за результатами лечения является протромбиновый индекс. Для профилактики и лечения используется викасол в дозе 1-2 мл 2–3 раза в день внутримышечно.
Нарушения гемостаза при заболеваниях печени
Печень принимает участие в синтезе или метаболизме всех факторов коагуляции, поэтому при тяжелых заболеваниях печени могут встречаться различные нарушения гемостаза.
Основные причины развития патологии:
1) снижение синтеза плазменных факторов (фибриногена, протромбина, факторов V, VII, IX, X, XI, XII, XIII, прекалликреина, высокомолекулярного кининогена, антиплазмина, антитромбина III, протеинов C и S);
2) снижение клиренса факторов коагуляции (фибрин-мономера, тромбоцитарного фактора 3, факторов IXа, Xа, XIа, активаторов плазминогена);
3) повышенное разрушение факторов коагуляции (при диссеминированном внутрисосудистом свертывании, патологии фибринолиза);
4) тромбоцитопения (при гиперспленизме, дефиците фолиевой кислоты, хронической алкогольной интоксикации, диссеминированном внутрисосудистом свертывании);
5) дисфункция тромбоцитов (при острой и хронической алкогольной интоксикации, уремии, влиянии продуктов деградации фибриногена).
Нарушения гемостаза при заболеваниях печени чаще всего клинически манифестируют желудочно-кишечными кровотечениями. Геморрагический синдром сложно однозначно связать с изменениями в системе крови, поскольку практически всегда имеется локальный источник кровотечения (варикозное расширение вен пищевода, пептические язвы и др.). Возможны также длительные кровотечения после хирургического вмешательства, экстракции зуба, диагностических процедур (биопсия). Геморрагические проявления на коже возникают относительно редко.
Лабораторными показателями, которые свидетельствуют о высокой вероятности кровотечения, являются увеличение протромбинового времени, в меньшей степени – снижение протромбинового индекса.
Наиболее часто для лечения коагулопатий, обусловленных заболеваниями печени, используется викасол, который оказывает хороший эффект у 30-40% пациентов. При выраженном геморрагическом синдроме необходима заместительная терапия свежезамороженной плазмой или фракцией плазмы, обогащенной протеинами протромбинового комплекса в сочетании с гепарином с целью профилактики тромботических осложнений.
Источник
Витамин К (филлохинон)
Витамин К (филлохинон) – это жирорастворимый витамин, необходимый для осуществления свертывания крови и минерализации костной ткани.
Антигеморрагический витамин, 2-метил-3-фитил-1,4-нафтохинон, витамин коагуляции, антигеморрагический витамин, фитонадион.
Phytonadione, menaphthone, vitamin Kj, Vit K.
Высокоэффективная жидкостная хроматография-масс-спектрометрия (ВЭЖХ-МС).
Нг/мл (нанограмм на миллилитр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 2-3 часов до исследования, можно пить чистую негазированную воду.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
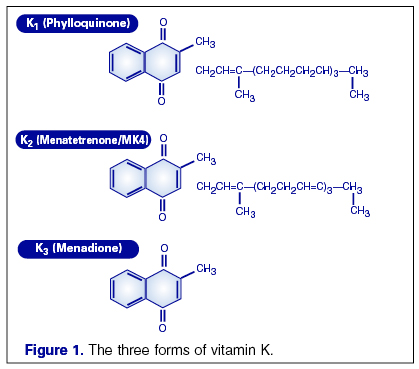
Витамин К является жирорастворимым витамином и существует в трех структурных вариантах: витамин К1 (филлохинон), К2 (менахинон) и К3 (менадион). Кроме различия в строении молекулы, филлохинон и менахинон отличаются по источнику поступления в организм.
Филлохинон встречается в продуктах растительного и животного происхождения. Большое количество филлохинона содержится в зеленых овощах (брюссельская и белокочанная капуста, салат-латук, шпинат, петрушка) и растительных маслах (оливковое и подсолнечное масла). Филлохинон – основная форма витамина К, поступающего с пищей.
В отличие от филлохинона, менахинон не поступает извне, а вырабатывается в кишечнике микрофлорой. В подвздошной кишке под воздействием желчных кислот и солей происходит всасывание обеих форм витамина К, а главным органом, где они запасаются, является печень. Менее липофильный филлохинон легко мобилизуется из ткани печени и активно расходуется в метаболических процессах. Соответственно, филлохинон является и преобладающей формой витамина К, присутствующей в сыворотке крови.
Некоторые факторы, такие как возраст, пол, менопауза, влияют на метаболизм витамина К. Запасы филлохинона у людей старше 60 лет меньше, чем у более молодых (до 40 лет). Кроме того, имеются генетические особенности метаболизма витамина К. Так, у пациентов – носителей полиморфного варианта E2 гена ApoE он более медленный. Это следует учитывать при назначении препаратов кумарина для лечения гиперкоагуляционных состояний (характеризующихся повышенной свертываемостью крови).
Витамин К первоначально получил название koagulations vitamin – так датский ученый назвал открытое им вещество, необходимое для осуществления свертывания крови, а именно для гамма-карбоксилирования факторов свертывания крови II, IV, IX и X, а также естественных антикоагулянтов протеина C и протеина S. Гамма-карбоксилированные факторы обладают уникальной способностью связывать IV фактор свертывания крови – ионы кальция. Процесс гамма-карбоксилирования осуществляется гепатоцитами. При отсутствии витамина К возникает дефицит указанных факторов свертывания, что проявляется повышенной кровоточивостью.
Несмотря на то что ежедневно около 60-70 % поступившего с пищей филлохинона выводится из организма с мочой или желчью, дефицит витамина К встречается достаточно редко. Это обусловлено, прежде всего, присутствием этого витамина во многих продуктах питания и запасами витамина в печени. Дефицит витамина К в подавляющем большинстве случаев вызван нарушениями его всасывания в тонкой кишке. Подобные нарушения сопровождают такие заболевания, как целиакия, болезнь Крона, болезнь Уиппла, муковисцидоз, а также состояние после резекции терминального отдела подвздошной кишки. При хроническом панкреатите дефицит липазы приводит к нарушению расщепления жиров до молекул жирных кислот и моноглицеридов, что значительно затрудняет всасывание жирорастворимых витаминов, в том числе и витамина К. Схожая ситуация возникает при гипергастринемии: при этом избыток гастрина стимулирует выработку большого количества соляной кислоты в желудке, которая инактивирует панкреатическую липазу. Поэтому у пациентов с язвой двенадцатиперстной кишки, антральным гастритом и синдромом Золлингера – Эллисона всасывание витамина К снижено. При заболеваниях печени и желчного пузыря нарушена продукция и секреция желчи, необходимой для всасывания витамина К, так что при хронических гепатитах и циррозе печени, хроническом холангите и холецистите абсорбция витамина К также снижена. Недостаток желчных кислот и солей наблюдается и при дисбактериозе кишечника. При этом микроорганизмы используют желчные кислоты для осуществления собственных метаболических процессов раньше, чем желчь поступает в терминальный отдел подвздошной кишки. Гиполипидемическое средство холестирамин связывает избыток холестерина и желчных кислот в кишечнике, что также затрудняет всасывание витамина К. Редкое генетическое заболевание абеталипопротеинемия сопровождается нарушением транспорта жиров из кишечника в лимфу, а затем в системную циркуляцию, при этом транспорт витамина К также нарушен.
Дефицит витамина К можно заподозрить при частых носовых кровотечениях, мено- и метроррагиях, экхимозах, позднем кровотечении в послеоперационном периоде (например, после удаления зуба), спонтанном или развившемся на фоне минимальной травмы кровоизлиянии в сустав, мышцу и забрюшинную полость. Следует отметить, что такая симптоматика свойственна не только дефициту витамина К. Наоборот, эти проявления встречаются при всех заболеваниях, сопровождающихся качественным или количественным изменением факторов свертывания крови и фибринолиза. Для дифференциальной диагностики коагулопатий в клинической практике чаще всего проводят тесты на протромбиновое время и активированное частичное тромбопластиновое время (АЧТВ). Их недостаток заключается в том, что они являются непрямыми методами оценки дефицита тех или иных факторов, позволяют предположить, но не подтвердить дефицит витамина К как причину повышенной кровоточивости. Для подтверждения же дефицита витамина К используют непосредственно измерение концентрации филлохинона в сыворотке крови.
С помощью витамина К происходит созревание белка костной ткани остеокальцина. Остеокальцин синтезируется остеобластами и способен связывать ионы кальция, что обеспечивает обызвествление новообразованной кости. Для синтеза активного остеокальцина, как и для синтеза факторов свертывания крови, необходима реакция гамма-карбоксилирования, которая осуществляется только в присутствии витамина К. При дефиците витамина К гамма-карбоксилирования остеокальцина не происходит, что сопровождается понижением минерализации костной ткани. Поэтому дефицит витамина К способствует развитию остеопороза. Высокий уровень филлохинона в препубертатном периоде связан с высокой плотностью костной ткани у здоровых девочек. В период активного роста и формирования костной ткани достаточное потребление витамина К необходимо для профилактики остеопороза. В пожилом возрасте нехватка витамина K увеличивает скорость резорбции кости. Например, потребление с пищей витамина К в количестве менее 109 мкг/день повышает риск перелома шейки бедра. И наоборот, более 250 мкг/сут понижает риск перелома шейки бедра. В суточном рационе молодого человека в среднем присутствует около 80 мкг витамина К, что в целом соответствует принятым диетологическим рекомендациям (рекомендованное количество составляет 1 мкг/кг/сут). Содержание филлохинона в рационе пожилых людей, употребляющих много мучных продуктов и мало зеленых овощей, часто находится на нижней границе нормы. Несмотря на то что при таком уровне поступления витамина К клинически определяемой коагулопатии не развивается, этого количества оказывается недостаточно для полноценной минерализации костной ткани. Такое состояние рассматривается как субклинический дефицит витамина К. Своевременная диагностика и лечение субклинического дефицита витамина К улучшает состояние костной ткани. Поэтому определение концентрации витамина К используют для оценки нутриентного статуса, при комплексной оценке состояний костной ткани и разработке индивидуальных диетологических рекомендаций.
Для чего используется исследование?
- Для выяснения причины повышенной кровоточивости.
- Для профилактики, своевременной диагностики и лечения остеопороза, особенно в препубертатный период и в пожилом возрасте.
- Для комплексной оценки содержания витаминов и микроэлементов.
- Для разработки индивидуальных диетологических рекомендаций с учетом возраста, пола, гормонального статуса, а также некоторых генетических особенностей метаболизма.
Когда назначается исследование?
- При заболеваниях желудочно-кишечного тракта – тонкой кишки и поджелудочной железы, а также печени и желчного пузыря, – сопровождающихся мальабсорбцией жиров и жирорастворимых витаминов.
- При симптомах повышенной кровоточивости: частых носовых кровотечениях, мено- и метроррагии, экхимозах, позднем кровотечении в послеоперационном периоде, спонтанном или развившемся на фоне минимальной травмы кровоизлиянии в сустав, мышцу и забрюшинную полость.
- При наличии факторов риска остеопороза: постменопаузы, пожилого возраста, употребления большого количества алкоголя и кофе, малоподвижного образа жизни, дефицита солей кальция и витамина D и др.
- При компрессионных переломах позвонков, «переломе лучевой кости в типичном месте», переломе шейки бедра, а также спонтанных или вызванных минимальной травмой переломах любых других локализаций.
- При разработке индивидуальных диетологических рекомендаций.
Источник
Полиморфизмы фактора VII и эпоксид-редуктазы витамина K в клинической практике
Фактор VII является одним из ключевых факторов в каскаде свертывания крови. Он относится к факторам свертывания крови, зависимым от витамина K. Уяснение роли VII фактора в свертывании крови и значения витамина K для нормальной коагуляции открывает путь к пониманию важнейших механизмов, лежащих в основе поддержания нормальной активности системы гемостаза, и механизмов развития патологии, приводящей к повышению риска кровотечений и тромбозов. Наследственные дефекты генов фактора VII и ферментов, участвующих в превращении витамина K могут влиять не только на риск тромбозов и кровотечений, но и на формирование плаценты и плацентарного кровообращения, риск осложнений беременности. Опыт показывает, что не только пациенты, но и многие врачи испытывают трудности с интерпретацией анализов на полиморфизм генов системы гемостаза. Надеемся, что данная статья окажется полезной врачам и пациентам, поможет улучшить качество подготовки к беременности и ведения беременности у женщин высокого риска осложнений беременности. Еще одной целевой аудиторией данной статьи являются врачи, ведущие пациентов с риском сосудистых и тромботических осложнений (терапевты, кардиологи, хирурги, педиатры).
Фактор VII. Общие понятия
Свертывание крови в норме является тонко регулируемой системой, обеспечивающей, с одной стороны, поддержание в жидком состонии крови внутри сосудов, но, с другой стороны, быстро включающейся в ответ на повреждение сосудов, предотвращая кровопотерю. Нормальное состояние крови поддерживается разнонаправленными механизмами, одни из которых обеспечивают активацию, а другие — торможение свертывания крови. При избыточной активности механизмов, способствующих коагуляции и при недостаточной активности механизмов, препятсвующих коагуляции появляется риск тромбозов — образование сгустков крови внутри сосудов, затрудняющих нормальное кровообращение. При противоположных ситуациях повышается риск кровотечений.
Фактор VII стоит в самом начале цепочки реакций самоусиления (каскадных реакций), в конечном итоге приводящих к образованию сгустка фибрина. Он был впервые открыт независимо друг от друга двумя группами исследователей в 1949 и в 1951 г. и имеет несколько синонимов, самым распространенным из которых является проконвертин. Фактор VII является гликопротеином, относящимся к группе витамин-K-зависимых сериновых протеаз. Он играет ключевую роль в свертывании крови. Другими витамин K-зависимыми факторами являются протромбин, факторы IX и X, а также протеины C и S.
Активация фактора VII происходит под воздействием тканевого фактора. Тканевой фактор является гликопротеином мембраны клетки, который в нормальных условиях «спрятан» под мембраной и поэтому не экспрессируется на поверхности выстилки сосудов. При повреждении стенки сосуда тканевой фактор попадает в кровь и начинает взаимодействовать с небольшими количествами активного (VIIa) и неактивного (VII) фактора VII. Это соединение резко ускоряет превращение фактора VII в фактор VIIa. Фактор VIIa в соединении с тканевым фактором в присутствии кальция и фосфолипидов облегчает превращение фактора IX в фактор IXa и фактора X в фактор Xa. Такая активация свертывания крови традиционно называется внешним путем активации гемостаза. Таким образом, комплекс фактора VIIa с тканевым фактором является мощным активаторов факторов IX и X.
Фактор VII имеет самый короткий период полужизни (6-8 часов) по сравнению со всеми другими факторами свертывания крови, поэтому при возникновении таких проблем, как нарушение функции печени или дефицит витамина K, уровень фактора VII в крови снижается быстрее всех витамин K-зависимых факторов.
Концентрация фактора VII повышается во время беременности у здоровых женщин. Концентрация активного фактора VII у носителей разных генетических вариантов фактора может различаться в несколько раз.
Фактор VII. Генетика и структура.
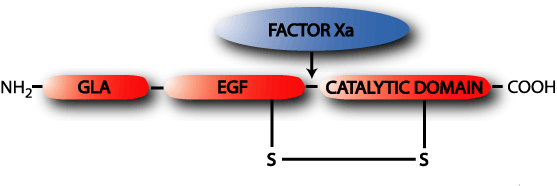
Ген VII фактора расположен на длинном плече 13-й хромосомы (13q34), недалеко от гена фактора X. Фактор VII синтезируется в печени и секретируется в виде гликопротеина, состоящего из одной пептидной цепочки молекулярной массой 48 кД. Подобно остальным витамин K-зависимые зимогенам фактор VII имеет Gla-домен, каталитический домен и домены, подобные эпидермальному фактору роста.
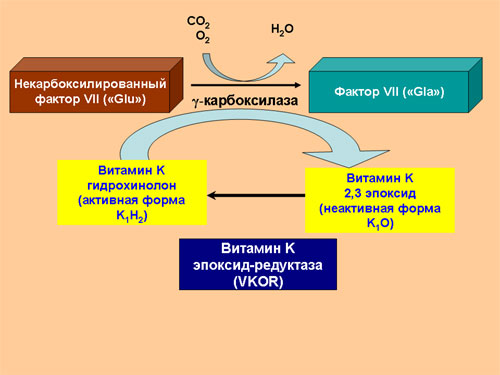
Аббревиатура Gla обозначает остаток гамма-карбоксиглутаминовой кислоты (gamma-carboxyglutamic acid). В синтезируемой внутри клетки белковой цепи фактора VII на N-конце находится 34 остатка глутаминовой кислоты (Glu). После завершения синтеза белка внутри клетки происходит карбоксилирование 10 таких остатков, в результате чего остатки глутаминовой кислоты превращаются в остатки гамма-карбоксиглутаминовой кислоты. Такая модификация белка называется посттрансляционным модифицированием. Пострансляционное модифицирование фактора VII происходит под действием фермента гамма-карбоксилазы в присутствии активной формы витамина K. В результате этой реакции витамин K выступает донором атомов водорода и превращается в неактивную окисленную форму (эпоксид витамина K). Обратное превращение неактивной формы витамина K в активную происходит под действием фермента витамин-K-эпоксид-редуктазы (VKOR, vitamin K oxoreductase). При дефиците витамина K и при снижении активности VKOR нарушается карбоксилирование всех витамин K-зависимых факторов свертывающей и противосвертывающей системы, что резко нарушает их функционирование, поскольку Gla-домен отвечает за взаимодействие факторов свертывания крови с фосфолипидами мембран.
Каталитический домен отвечает за ферментную активность фактора VII, а 2 домена, сходных с эпидермальным фактором роста отвечают за связь фактора VII с ионами кальция. В таком виде неактивный фактор VII поступает в кровь из печени. Активация фактора VII (превращение профермента (=зимогена) в активный фермент, обозначаемый аббревиатурой VIIa происходит в результате разрезания пептидной связи между остатком аргинина (Arg, R) в позиции 323 и остатком изолейцина (Ile, I) в позиции 324.
Фактор VII. Активация.
Итак, разрезание пептидной связи между остатком аргинина 152 и остатком изолейцина 153 приводит к образованию активной формы фактора VII (VIIa). В результате из N-конца пептидной цепочки образуется легкая цепь (мол. масса около 20000, а из C-конца — тяжелая цепь (мол. масса около 30000). Обе цепи остаются ковалентно связанными дисульфидным мосткиком. из N-
Быстрая активация происходит после соединения неактивного фактора VII со своим кофактором (тканевым фактором) в присутствии ионов кальция.
Полиморфизм Arg353Gln
К настоящему времени описано несколько полиморфизмов фактора VII. Большинство полиморфных вариантов приводят к снижению секреции фактора VII в кровь и к снижению активности фактора VII. Уровень антигена фактора VII в крови, отражающий общую концентрацию фактора обычно обозначается аббревиатурой VII:Ag (от слова antigen), а коагулянтная активность фактора, которая может не совпадать с концентрацией антигена — аббревиатурой VII:C (от слова coagulation, свертывание).
Полиморфизм Arg353Gln заключается в замене аргинина на глутамин в позиции 353. В системе однобуквенных кодов аминокислот, предложенной в начале 1960-х годов биохимиком Джоржтаунского университета Маргарет Оукли Дейхофф аргинин обозначается буквой R, а глутамин — буквой Q. Поэтому в литературе этот полиморфизм обозначается также как R353Q. Это одно и то же. Замена одной аминокислоты на другую в цепочке белка обусловлено точечной заменой в позиции 10976 цепочки гена одного азотистого основания (гуанина, G) на другое азотистое основание (аденин, A). Поэтому тот же самый полиморфизм может обозначаться как G10976A. Наличие варианта Gln в гетерозиготном состоянии (R/Q) приводит к снижению концентрации и активности фактора VII в крови на примерно на 25%, а наличие гомозиготности Q/Q — к снижению концентрации и активности фактора примерно на 50% по сравнению с обычными носителями варианта R/R. Данный полиморфизм был впервые описан Green и сотр. в 1991 г.
Концентрация фактора VII в крови находится под влиянием большого количества генетических факторов и факторов внешней среды. Последние включают в себя количество жиров в диете, возраст, наличие ожирения, наличие сахарного диабета, у женщин — начало менопаузы и назначение гормональной заместительной терапии. Концентрация фактора VII в крови хорошо коррелирует с уровнем триглицеридов. Чем выше уровень триглицеридов в крови, тем выше концентрация фактора VII.
Повышение концентрации фактора VII в крови сопровождается повышением риска таких заболеваний, как инфаркт миокарда и гипертоническая болезнь. В случае инфаркта миокарда вероятность летального исхода значительно повышается при высоких концентрациях фактора VII в крови. Во время беременности риск осложнений, связанных с нарушением функции плаценты бывает тем выше, чем выше концентрация фактора VII. Высокие концентрации фактора VII сопровождаются значительным повышением риска тромботических осложнений у женщин на фоне гормональной контрацепции и гормональной заместительной терапии, особенно в сочетании с курением, ожирением и сахарным диабетом.
Исследования последних лет показали, что наличие вариантов Q/Q и R/Q значительно снижает риск возникновения и тяжелого исхода инфаркта миокарда и гипертонической болезни. Более частый вариант R/R, наоборот, является дополнительным фактором риска сосудистых осложнений.
Многие осложнения беременности, сопровождающиеся риском нарушения плацентарной функции (остановка развития беременности на малых сроках, задержка внутриутробного развития, гипотрофия плода, фето-плацентарная недостаточность, некоторые виды аномалий внутриутробного развития плода) связаны с повышением риска тромбозов спиральных артерий. Ситуация усугубляется физиологическим повышением факторов свертывания крови при беременности, таких как фактор II (фибриноген) и фактор VII. Это объясняет интерес акушеров-гинекологов к полиморфизму фактора VII у беременных женщин и к включению определения данного полиморфизма при обследовании при осложненном течении беременности и после многократных неудачных попыток ЭКО. Л. А. Никитина и сотр. (2007) показали, что наличие варианта Gln снижает риск неблагоприятного исхода беременности. Было также установлено, что наличие генотипа R/R у внутриутробного плода является фактором риска атрезии тонкой кишки. Это связано с повышением риска тромбирования сосудов брыжейки у плода, что является одной из важных причин атрезии тонкой кишки (Johnson и Meyers, 2001). Сочетание варианта R/R c лейденской мутацией еще больше повышают риск атрезии тонкого кишки. Для выяснения риска повторения подобных осложнений беременности может потребоваться обследование мужа на полиморфизм генов гемостаза с целью прогнозирования вариантов генотипа плода.
Практические рекомендации по результатам обследования на полиморфизм фактора VII Arg353Gln (R353Q)
- Исследование на полиморфизм R353Q является важной составляющей частью обследования на полиморфизм генов системы гемостаза. Фактором риска, повышающим вероятность осложнений беременности является более частый вариант R. Полиморфный вариант Q снижает риск развития тромботических осложнений беременности.
- При наличии варианта R дополнительным фактором риска повышения концентрации фактора VII являются высокие уровни триглицеридов, избыток массы тела, прием гормональных контрацептивов и гормональной заместительной терапии. Поэтому важным дополнением к исследованию является определение липидограммы у пациента с включением в набор показателей триглицеридов. Липидная панель в таких случаях должна состоять из общего холестерина, липопротеидов низкой плотности, липопротеидов высокой плотности и триглицеридов. Важно также определение уровня глюкозы и проведение сахарной кривой. Обязательным является расчет индекса массы тела у пациента.
- В состав рекомендаций обязательно должны включаться рекомендации по диете, направленной на снижение потребления животных жиров и углеводов, включением в рацион олеиновой и пальмитиновой кислот (омега-3 кислот). Желательна умеренная физическая нагрузка под контролем специалиста по лечебной физкультуры в составе комплекса мер по борьбе с избыточной массой тела.
- Следует помнить, что протективный вариант Q может сочетаться с такими факторами риска тромбофилии как лейденская мутация, гомозиготная форма 4G/4G мутации PAI-1 и т. д., которые могут потребовать назначения гипокоагулянтной терапии в составе низкодозированной ацетилсалициловой кислоты и препаратов гепарина. Относительный дефицит фактора VII у таких пациенток может приводить к повышению риска кровотечений на фоне антикоагулянтной.
- Поскольку внутриутробный плод наследует один экземпляр гена от отца, а другой от матери, и часть осложнений беременности связано не только с генотипом матери, но и с генотипом внутриутробного плода (развитие тромбозов у плода), в некоторых случаях бывает необходимо обследование мужа на полиморфизмы генов системы гемостаза с целью расчета рисков повторения ситуации при следующей беременности и разработки адекватной тактики подготовки к беременности.
Витамин K

Витамин K включает в себя группу жирорастворимых витаминов, которые необходимы для посттрансляционной модификации нескольких белков, большинство которых является белками свертывающей и противосвертывающей системы крови. Химически они относятся к производным 2-метил-1, 4 нафтохинолона.
Все члены семейства витамина K имеют метилированное нафтохинолоновое кольцо и боковую цепь, содержащую различное число остатков изопрена. Филлохинолон (витамин K1) имеет 4 остатка изопрена в боковой цепи, один из которых ненасыщен. Менахинолоны (витамин K2) содержат различное количество ненасыщенных остатков изопрена. Обычно они обозначаются как MK-n, где n — число остатков изпорена. Наличие остатков изопрена сближает витамины K с другими жирорастворимыми витаминами (A, E и убихинолоны (коэнзимы Q)). Витамины K1 и K2 являются единственными природными витаминами K. Остальные витамины K (K3, K4 и т. д.) являются синтетическими препаратами.
Витамин K1 содержится в зеленых овощах (шпинат, латук, цветная капуста, злаках, авокадо, киви, бананах, в мясе, молочных продуктах, яцах, сое, растительных маслах, в частности, в оливковом масле. Витамин K2 сннтезируется бактериями кишечника, поэтому авитаминоз витамина K у взрослых — редкое являение, в основном — при дисбактериозах после лечения антибиотиками. Однако у маленьких детей, у которых кишечник еще не заселен бактериями в достаточном количестве, нередко наблюдается гиповитаминоз K, который может давать склонность к кровотечениям. Витамин K не проникает через плаценту.
Как указывалось выше, витамин K необходим для карбоксилирования остатков глутаминовой кислоты в некоторых белках, которые превращаются в остатки гамма-карбоксиглутаминовой кислоты (Gla). Белки, которые претерпевают такую посттрансляционную модификацию называются Gla-белками.
У человека известно 14 Gla-белков:
- Белки свертывания крови: протромбин (фактор II), факторы VII, IX, X, протеины C, S и Z
- Белки костного метаболизма: остеокальцин (синоним: костный Gla-протеин, BGP) матриксный Gla-протеин (MGP)
- Участие в восстановлении сосудов (ангиогенезе)
Полиморфизм VKORC1 C1173T
Ген VKORC1 кодирует субъединицу 1 комплекса эпоксид-редуктазы витамина K. Это мембранный протеин, состоящий из одной пептидной цепи, состоящей из 163 аминокислотных остатков, тесно связанный с эндоплазматическим ретикулумом. Как было показано выше, этот фермент переводит неактивную (окисленную) форму витамина K, поступающую в организм, в активную (редуцированную) форму, участвующие в пострансляционном карбоксилировании витамин K-зависимых белков. Дефицит фермента может приводить к тотальному снижению активности всех витамин-K-зависимых факторов.
Как и ожидалось, наибольшая концентрация VKORC1 была обнаружена в клетках печени, в которой синтезируются факторы свертывания крови. Однако активность фермента не ограничивается только клетками печени. Значительная активность была обнаружена и в клетках сосудистой стенки, костной ткани, в плаценте, пуповине и других тканях плода.
Огромный интерес к гену VKORC1 возник после того, как выяснилось, что полиморфизм гена, проявляющийся в виде замены остатка цитозина (C) на остаток тимина (T) в позиции 1173 (первый интрон гена) объясняет различия действия непрямых антикоагулянтов на организм. Было давно замечено, что существует 3 группы людей, с существенными различиями в эффективной дозе непрямых антикоагулянтов. В группу A входят пациенты, требующие минимальной дозы препаратов для достижения клинического эффекта, в группу B — пациенты, которым требуется значительно большая доза и группа AB, которым требуется промежуточная доза. Долгое время было непонятно, с чем связаны такие различия. Возможным объяснением было то, что у разных людей разрушение непрямых антикоагулянтов в организме происходит с разной скоростью. И действительно, был обнаружен полиморфизм в гене фермента, участвующего в разрушении непрямых антикоагулянтов (CYP2C9), частично объясняющим такие различия, однако полностью явление разной чувствительности к непрямым антикоагулянтам оставалось неясным. И только открытие полиморфизма VKORC1 C1173T все расставило по местам. Оказалось, что у людей, являющихся носителями генотипа T/T скорость синтеза, а потому и концентрация фермента внутри клетки минимальная. Поэтому для блокады работы фермента требуются малые дозы препаратов. У людей, имеющих генотип C/C скорость транскрипции гена максимальная, а потому и для блокады фермента требуются большие дозировки. Людям с генотипом C/T требуются промежуточные дозы непрямых антикоагулянтов.
Это открытие поистине произвело революцию в назначении этих препаратов, являющимися одними из важных в лечении и профилактике тромбозов, инфарктов и других сосудистых осложнений. У врачей появился метод прогнозирования оптимальной дозы препарата еще до его назначения. Это позволяет значительно улучшить прогноз лечения: выбрать дозу, адекватно понижающую избыточную свертываемость крови и не создать риска кровотечения. Американское агентство FDA включило исследование полиморфизма VKORC1 в число рекомендуемых перед назначением лечения непрямыми антикоагулянтами.
Дальнейшие исследования позволили предположить роль полиморфизма VKORC1 не только в чувствительности организма к непрямым антикоагулянтам, но и плане возможной предрасположенности к развитию других заболеваний, в частности к венозным тромбозам. По предварительным данным (Circulation 2006; 113: 1615-1621) наличие гаплотипа СС может удваивать риск инфаркта миокарда или инсульта. По данным недавнего французского исследования (Lacut и сотр., октябрь 2007)
Может оказаться, что значение полиморфизма VKORC1 выходит за рамки только подбора дозы оральных антикоагулянтов, поскольку фермент участвует не только в регуляции гемостаза, но и в апоптозе (программируемой смерти клетки), развитии костей, кальцинировании стенки артерий, проведении сигнала и контроле роста. Внимание акушеров должен обратить тот факт, что по предварительным данным вариант C/C в значительно большей степени предрасполагает к образованию кальцинатов в стенке артерий (Teichert M. и сотр., январь 2008). Скорее всего, в ближайшее время будут проведены исследования о возможной связи старения плаценты и образования в ней кальцинатов с полиморфизмом гена VKORС1.
Отдельная тема, почти не исследованная на сегодняшний день — это значение полиморфизма VKORC1 для риска осложнений беременности. Было показано, что высокая активность фермента внутри клеток коррелирует с пролиферацией, миграцией, адгезией и формированием сосудистой сети клеток эндотелия пуповины (Wang и сотр., 2006). Можно предположить, что наличие вариантных генотипов VKORC1 у плода может влиять на плацентацию и ангиогенез в плаценте. Вариант C/C является неблагоприятным вариантом в случае дефицита витамина K в организме. Дефицит витамина K у беременных обнаруживается довольно редко, однако не исключен. Вероятность его повышается в случае неправильной диеты, после лечения антибиотиками, при хронических заболеваниях печени. В марте 2005 г. французские авторы (Jessica Jaillet и сотр.) опубликовали случай рождения ребенка с синдромом Биндера (неправильное формирование носа и верхней челюсти) у женщины с желчекаменной болезнью и доказанным дефицитом витамина K в первом триместре. В 11 недель беременности у женщины было обнаружено снижение факторов II, VII, X свертывания крови, а также удлинение протромбинового времени, характерных признаков дефицита витамина K. Хотя это единственный опубликованный на сегодняшний день случай, он не должен пройти без внимания врачей акушеров-гинекологов. При наличии дисбактериоза или других факторов риска дефицита витамина K женщинам с генотипом C/C можно было предложить несколько инъекций витамина K на этапе подготовки к беременности.
Заключение
Мы затронули одну из важных тем современной медицины: значение генов витамин-K-зависимых факторов для здоровья и болезни. Возможности современной лабораторной диагностики позволяют выяснить конфигурацию генов у человека и на основе этой конфигурации разработать меры по профилактике заболеваний и продлению жизни человека, обеспечению здоровья потомства. Данная статья является продолжением наших публикаций по геномике и молекулярной генетике:
Источник