Витамин В12
Витамин В12 (кобаламин; антианемический витамин) выделен из печени в кристаллическом виде в 1948 г. Задолго до этого было известно, что в печени животных содержится особое вещество, регулирующее процесс кроветворения и оказывающее лечебный эффект при пернициозной (злокачественной) анемии у людей. Однако только в 1955 г. Д. Ходжкин расшифровала его структуру, включая трехмерную пространственную конфигурацию, главным образом при помощи физических методов исследования (рентгенографическая кристаллография). На основании этих данных, а также результатов изучения химического состава для витамина В12 было предложено следующее строение:
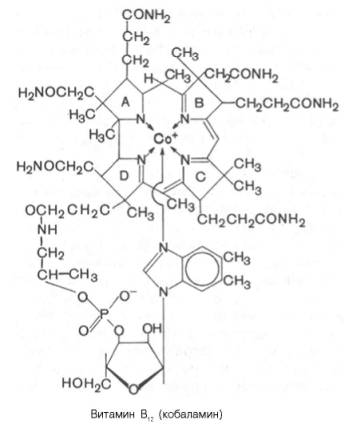
В молекуле витамина В12 центральный атом кобальта соединен с атомами азота четырех восстановленных пиррольных колец, образующих порфириноподобное корриновое ядро, и с атомом азота 5,6-диметил-бензимидазола . Кобальтсодержащая часть молекулы витамина представляет собой планарную (плоскостную) фигуру; по отношению к ней перпендикулярно расположен нуклеотидный лиганд, который, помимо 5,6-диметилбензимидазола, содержит рибозу и остаток фосфата у 3-го атома углерода. Вся структура получила название «кобаламин». Были получены производные витамина В12, содержащие ОН-группу (оксикобаламин), хлор (хлоркобаламин), Н2О (аквакобаламин) и азотистую кислоту (нитрито-кобаламин). Из природных источников были выделены, кроме того, аналоги В12, которые вместо 5,6-диметилбензимидазола содержали 5-окси-бензимидазол, или аденин, 2-метиладенин, гипоксантин и метилгипок-сантин. Все они обладали меньшей биологической активностью, чем ко-баламин. Обычно витамин В12 выделяют из микробной массы или животных тканей, используя растворы, содержащие ионы цианида, которые выполняют роль 6-го лиганда кобальта. Однако цианокобаламин метаболически неактивен. В состав В12-коферментов вместо CN входит остаток 5-дезоксиаденозина или метильная группа.
У человека и животных недостаток витамина В12 приводит к развитию злокачественной макроцитарной, мегалобластической анемии. Помимо изменений кроветворной функции, для авитаминоза В12 специфичны также нарушения деятельности нервной системы и резкое снижение кислотности желудочного сока. Оказалось, что для активного процесса всасывания витамина В12 в тонкой кишке обязательным условием является наличие в желудочном соке особого белка – гастромукопротеина, получившего название внутреннего фактора Касла, который специфически связывает витамин В12 в особый сложный комплекс. Точная роль этого фактора во всасывании В12 не выяснена. Предполагают, что в связанном с этим фактором комплексе витамин В12 поступает в клетки слизистой оболочки подвздошной кишки, затем медленно переходит в кровь портальной системы, а внутренний фактор подвергается гидролизу (распаду). Следует указать, что В12 поступает в кровь портальной системы не в свободном состоянии, а в комплексе с двумя белками, получившими название транскобаламинов I и II, один из которых выполняет функцию депо В12 (I), поскольку он более прочно связывается с витамином В12. Поэтому нарушение синтеза внутреннего фактора в слизистой оболочке желудка приводит к развитию авитаминоза В12 даже при наличии в пище достаточного количества кобаламина. В подобных случаях витамин с лечебной целью обычно вводят парентерально или с пищей, но в сочетании с нейтрализованным желудочным соком, в котором содержится внутренний фактор. Подобный метод лечения эффективен при пернициозной анемии. Это указывает на существование определенной связи между развитием злокачественной анемии у человека и нарушением функций желудка. Можно, вероятно, утверждать, что пернициозная анемия, хотя и является следствием авитаминоза В12, но развивается на фоне органических поражений желудка, приводящих к нарушению синтеза в клетках слизистой оболочки желудка внутреннего фактора Касла, или после тотального удаления желудка хирургическим путем.
Витамин В12 используется в клинике для лечения не только перни-циозной анемии, но и других ее форм – мегалобластических анемий с неврологическими нарушениями, которые обычно не поддаются лечению другими витаминами, в частности фолиевой кислотой.
Биологическая роль. Выявлены ферментные системы, в составе которых в качестве простетической группы участвуют не свободный витамин В12, а так называемые В12-коферменты, или кобамидные коферменты. Последние отличаются тем, что содержат 2 типа лигандов: метильную группу и 5′-дезоксиаденозин. Соответственно различают метилкобаламин СН3-В12 и дезоксиаденозилкобаламин. Превращение свободного витамина В12 в В12-коферменты, протекающее в несколько этапов, осуществляется в организме при участии специфических ферментов в присутствии в качестве кофакторов ФАД, восстановленного НАД, АТФ и глутатиона. В частности, при образовании 5-дезоксикобаламинового кофермента АТФ подвергается необычному распаду с отщеплением три-фосфатного остатка по аналогии еще с одной единственной реакцией синтеза 5-аденозилметионина из метионина и АТФ (см. главу 12). Впервые В12-коферменты были выделены Г. Баркером и сотр. в 1958 г. из микроорганизмов, позже было доказано их существование в тканях животных.
Химические реакции, в которых витамин В12 принимает участие как кофермент, условно делят на 2 группы в соответствии с его химической природой. К первой группе относятся реакции трансметилирования, в которых метилкобаламин выполняет роль промежуточного переносчика метильной группы (реакции синтеза метионина и ацетата).
Синтез метионина требует, помимо гомоцистеина, наличия N 5 -метил-ТГФК и восстановленного ФАД и протекает согласно уравнению:
Фермент, катализирующий эту реакцию, был открыт в печени человека и ряда животных, а также у микроорганизмов. Получены доказательства, что механизм реакции включает перенос метильной группы N 5 -СН3-ТГФК на активный центр фермента с образованием метил-В12-фермента и последующий перенос этой группы на гомоцистеин. Блокирование этой реакции, наблюдаемое при авитаминозе В12, приводит к накоплению N 5 -СН3-ТГФК и соответственно выключению из сферы химических реакций еще одного важного кофермента.
Вторая группа реакций при участии В12-коферментов заключается во внутримолекулярном переносе водорода в реакциях изомеризации. Механизм этих реакций соответствует схеме:
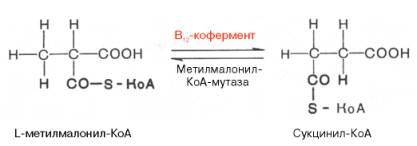
Видно, что протон водорода движется (перемещается) между двумя соседними атомами углерода и не обменивается с протонами воды. Предполагают, что сначала водород от субстрата переносится на 5-дезокси-кобаламин, а затем обратно на субстрат, меняя местоположение. Например, глутаматмутазная реакция (взаимопревращения глутаминовой и β-метиласпарагиновой кислот), метилмалонилмутазная реакция (обратимое превращение метилмалонил-КоА в сукцинил-КоА), глицерол- и диол-дегидратазные реакции, ферментативные реакции восстановления рибо-нуклеотидов до дезоксирибонуклеотидов и др. В организме человека из указанных процессов открыта только реакция изомеризации метил-малонил-КоА в сукцинил-КоА.
Следует подчеркнуть, что реакция изомеризации метилмалонил-КоА требует наличия 5′-дезоксиаденозилкобаламина в качестве кофермента, в то время как реакция метилирования (см. ранее) нуждается в метилкобала-мине. Этими обстоятельствами могут быть объяснены некоторые биохимические симптомы недостаточности витамина В12, в частности метил-малонилацидурия и гомоцистинурия. Кроме того, описаны болезни, обусловленные наследственными дефектами синтеза только дезоксиаденозил-кобаламина или обоих В12-коферментов; в этих случаях даже 1000-кратная доза витамина В12 не оказывала лечебного эффекта. В настоящее время высказывается предположение о более широком участии В12-коферментов в ферментативных реакциях трансметилирования, дезаминирования (например, этаноламиддезаминазная реакция) и др. Предстоит, однако, приложить немало усилий, чтобы выяснить молекулярные механизмы действия витамина В12 на процесс кроветворения. Положительный эффект при лечении пернициозной анемии полусырой печенью обусловлен, как стало известно, наличием витамина В12, хотя следует указать, что большего лечебного эффекта можно добиться при одновременном введении внутреннего фактора слизистой оболочки желудка.
Распространение в природе и суточная потребность. Витамин В12 является единственным витамином, синтез которого осуществляется исключительно микроорганизмами; ни растения, ни ткани животных этой способностью не наделены. Основные источники витамина В12 для человека – мясо, говяжья печень, почки, рыба, молоко, яйца. Главным местом накопления витамина В12 в организме человека является печень, в которой содержится до нескольких миллиграммов витамина. В печень он поступает с животной пищей, в частности с мясом, или синтезируется микрофлорой кишечника при условии доставки с пищей кобальта. Суточная потребность в витамине В12 для взрослого человека составляет около 3 мкг (0,003 мг).
Источник
Микробиологический синтез витамина В12
СИНТЕЗ ВИТАМИНА В12

Общая информация о получении витамина В12
Из всех витаминов, методом микробиологического синтеза производят в основном витамин В12 и его коферментную форму. Продуцентами в этом процессе служат пропионовокислые бактерии . Для получения кормовых концентратов, содержащих витамин В12, на отходах бродильной промышленности (послеспиртовые, ацетоно-бутиловые барды и др.) применяют комплекс метанообразующих бактерий.
Физиология прокариот (бактерий) — центральное направление микробиологии, формирующее целостное представление о жизнедеятельности организма. Изучение физиолого-биохимических свойств практически значимых микроорганизмов актуально в плане решения общечеловеческой задачи — улучшения качества жизни. Пропионовокислые бактерии (ПКБ) имеют разнообразное практическое применение. Достаточно напомнить, что Propionibacterium freudenreichii subsp. shermanii — основная и незаменимая культура, используемая в мировом производстве «твёрдых» сыров , а в России — и в производстве витамина B12 , однако области применения ПКБ этим не ограничены. Поэтому биология ПКБ находится под постоянным «прицелом» специалистов разных профилей. Регулярно проводится международный тематический симпозиум «Propionibacteria». В различных исследованиях значительное внимание уделено роли кобальта и кобаламина (истинного витамина В12) в биосинтезе корриноидов — соединений группы витамина В12. Также сегодня весьма актуально и изучение значения ионов кобальта и корриноидов для жизнедеятельности самих пропионовокислых бактерий.
Молекулярная структура кобаламинов (витамина В12)
Витамин B12 — первое органометаллическое соединение, выделенное из биологической системы. Из неполимерных органических соединений имеет наиболее сложное строение, изображенное на рисунке. Молекула состоит из двух почти планарных циклических структур и линейного участка. Металл Со+3 связан с макроциклом, сильно напоминающим порфириновое ядро гема. Это тетрапиррольная структура, но имеющая ту особенность, что вместо метановых мостиков, связывающих 4 пиррольных кольца, кольца А и D непосредственно связаны. Вторая кольцевая структура — азотистое основание — 5,6-диметилбен-зимидазол (5,6 ДМБ>. 5,6 ДМБ соединен с первой кольцевой системой гетерогенной боковой цепью, состоящей из N-амино-2-пропанола (изопропанола), этерифицированного фосфатом 3-мононуклеотида, связанного с основанием 5,6 ДМБ Na-гликозидной связью.
Структура витамина В12 не только очень сложная, но содержит некоторые необычные части: 1) корриновая структура ранее не была известна в органической химии (до открытия витамина В12 в 1948 г. независимо Риксом и Смитом); 2) Na-гликозидная связь встречается в природе очень редко и обнаружена лишь в нескольких соединениях, содержащих рибозо-3-фосфат; 3) 5,6 ДМБ тоже принадлежит к уникальным соединениям и встречается в природе только в составе кобаламинов.
Атом кобальта имеет 6 координационных связей; 4 из них заняты пиррольными кольцами. Одна — N-3-5,6 ДМБ и последняя — верхним лигандом (У), природа которого может варьировать. В коммерческом витамине В12 (цианкобаламине) лиганд -CN-группа (артефакт процесса выделения).
In vivo чаще всего встречаются дезоксиаденозильная группа (Co-B12-I), метильная группа (метилкобаламии, СН3-B12-CoB-II) или оксогруппа (оксокобаламин). Кроме этих соединений, известных как кобаламины, есть другие корриноидные соединения с иным нуклеотид-аным основанием.

Продуценты витамина B12.
В природе витамин В12 и родственные корриноидные соединения находят в клетках микроорганизмов, в тканях животных и некоторых высших растениях (горох, лотос, побеги бамбука, листья и стручки фасоли). Однако происхождение витамина В12 в высших растениях окончательно не установлено. Такие низшие эукариоты, как дрожжи и мицелиальные грибы, корриноиды, по-видимому, не образуют. Организм животных не способен к самостоятельному синтезу витамина. Среди прокариот способность к биосинтезу корриноидов широко распространена. Активно продуцируют витамин В12 представители рода Propionibacterium. Природные штаммы пропионовокислых бактерий образуют 1,0—8,5 мг/л корриноидов, но получен мутант P. shermanii M.- 82, с помощью которого получают до 58 мг/л витамина. В семействе Propionibacteriaceae есть и другие представители, способные к высокому накоплению витаминами В12 в клетках. Это, прежде всего, Eubacterium limosum (Batyribacterium retteerii). Как продуценты витамина практический интерес имеют многие представители актиномицетов и родственных микроорганизмов. Истинный витамин В12 в значительных количествах синтезирует Nocardia rugosa. Путем мутаций и отбора получен штамм N. rugosa, накапливающий до 18 мг/л витамина В12. Активные продуценты витамина обнаружены среди представителей рода Micromonospora: M. purpureae, M. echinospora, M. halophitica, M. fusca, M. chalceae.
Высокой кобаламинсинтезирующей активностью обладают метаногенные бактерии, например, Methanosarcina barkeri, M. vacuolata и отдельные штаммы галофильного вида Methanococcus halophilus. Последний организм синтезирует более 16 мг корриноидов на грамм биомассы. Столь высокого содержания корриноидов не отмечено ни у одного другого из изученных микроорганизмов. Причина высокого содержания корриноидов у метаногенных бактерий не установлена. Корриноиды синтезируют строго анаэробные бактерии из рода клостридий. У Clostridium tetanomorphum и Cl. Sticklandii аденозилкобаламин входит в состав ферментных систем, катализирующих специфические реакции изомеризации таких аминокислот, как глутаминовая, лизин и орнитин. В значительных количествах образуют витамин В12 ацетогенные клостридии Cl. thermoaceticum, Cl. formicoaceticum и Acetobacter woodi, синтезирующие ацетат из СО2. Известны активные продуценты витамина B12 у псевдомонад, среди которых лучше других изучен штамм Pseudomonas denitrificans MB-2436 — мутант, дающий на оптимизированной среде до 59 мг/л корриноидов. Корриноиды синтезируют Rhodopseudomonas, фототрофные пурпурные бактерии Rhodobacter sphericus , Rh. Capsulatus, Rhodospirillum rubrum, Chromatium vinosum и ряд других видов. Наряду с витамином В12 они образуют бескобальтовые корриноиды, роль которых для продуцентов не установлена. Значительные количества витамина В12 образует цианобактерия Anabaena cylindrica, одноклеточные зеленые водоросли Chlorella pyrenoidosae и красные водоросли Rhodosorus marinus. Продуценты витамина B12 культивируют в средах, приготовленных на основе пищевого сырья: соевой муки, рыбной муки, мясного и кукурузного экстракта. В последние годы выявлены микроорганизмы, образующие высокие качества корриноидов при утилизации непищевого сырья.
Получение и применение витамина В12
Мировая продукция витамина В12 составляет 9 — 11 тыс. кг в год; из них 6,5 тыс кг используют на медицинские цели, а остальное — для животноводства. Производство витамина В12 основано главным образом на культивировании пропионовокислых бактерий (Великобритании, Венгрии), мезофильных и термофильных меганогенных бактерий (Венгрия), а также актиномицетов и родственных форм (Италия).
В СНГ в качестве продуцента витамина В12 используют пропионовокислые бактерии P. shermanii . Для получения витамина B12 бактерии культивируют периодическим методом в анаэробных условиях в среде, содержащей кукурузный экстракт, глюкозу, соли кобальта и сульфат аммония. Образующиеся в процессе брожения кислоты нейтрализуют раствором щелочи, который непрерывно поступает в ферментер. Через 72 ч. в среду вносят предшественник — 5,6-ДМБ. Без искусственного введения 5,6-ДМБ бактерии синтезируют фактор В и псевдовитамин В12 (азотистым основанием служит аденин), не имеющие клинического значения. Ферментацию заканчивают через 72 ч. Витамин B12 сохраняется в клетках бактерий. Поэтому после окончания брожения биомассу сепарируют и экстрагируют из нее витамин водой, подкисленной до рН 4,5 — 5,0 при 85 — 90°С в течение 60 мин. с добавлением в качестве стабилизатора 0,25 % NaNO2.
Водный раствор витамина В12 охлаждают, доводят рН до 6,8 — 7,0 50 %-ным раствором NaOH. К раствору добавляют Al2(SO4)3* 18Н2О и безводный FeCl3 для коагуляции белков и фильтруют через фильтр — пресс. Очистку раствора проводят на ионообменной смоле СГ-1,с которой кобаламины элюируют раствором аммиака. Далее проводят дополнительную очистку водного раствора витамина органическими растворителями, упаривание и очистку на колонке с Аl2О3, с окиси алюминия кобаламины элюируют водным ацетоном. К водно-ацетоновому раствору витамина добавляют ацетон и выдерживают 24 — 48 ч. при 3 — 4°С. Выпадающие кристаллы витамина отфильтровывают, промывают сухим ацетоном и серным эфиром и сушат в вакуум-эксикаторе над Р2О5. Для предотвращения разложения В12 все операции необходимо проводить в сильно затемненных помещениях или при красном свете. Таким образом можно получить не только смесь CN- и оксикобаламинов, но и коферментную форму, которая обладает высоким терапевтическим эффектом.
Промышленность выпускает различные формы лечебных препаратов кобаламинов: ампулы со стерильным раствором CN – B12, приготовленного на 0,9 % растворе NaCl, таблетки CN — В 12 и в смеси с фолиевой кислотой, таблетки, (муковита), содержащие CN — B 12 и мукопротеид. Лечебные препараты в ампулах: камполон, антианемин и гепавит содержат водный экстракт печени крупного рогатого скота. Перспективны исследования по мутагенезу пропионовокислых бактерий как один из способов повышения продуктивности штамма, а также проверки и внедрения в производственные условия других продуцентов, растущих на дешевом непищевом сырье.

Установлено образование корриноидов не только в смешанной, но и в чистой культуре метанобразующих бактерий Methanosarcina barkeri, Methanobacterium formicum при росте в присутствии Н2 и СО2. Содержание корриноидов у метанобразующих бактерий составляет 1,0 — 6,5 мг/г сухой биомассы. С помощью смешанной культуры метанобразующих бактерий разработан метод получения кормового препарата витамина В12 — КМБ12. Субстратом для метанового брожения служит ацетоно-бутиловая и спиртовая барда. Ацетоно-бутиловую барду получают в результате удаления растворителей из культуральной жидкости Clostridium acetobutylicum , сбраживающей паточно-мучные заторы. Для метанового брожения используют декантат барды, содержащий 2,0 — 2,5 % сухих веществ. К декантированной барде добавляют 4 г/м 3 СоС12 и 0,5 % метанола как стимуляторов синтеза кобаламинов. В качестве биостимуляторов вносят также карбамид и диаммонийфосфат, 5,6-ДМБ не вносят, поскольку CN= B12 и фактор III, обладающие биологической активностью, составляют до 80 % от суммы всех корриноидов.
Исходная барда имеет температуру около 100°С и практически стерильна. Перед поступлением в ферментеры барда охлаждается до 55 — 57°С. В качестве исходной культуры используют смешанную культуру метанообразующих бактерий, осуществляющих термофильное метановое брожение сточных вод. Получение концентрата витамина В12 включает следующие технологические стадии: непрерывное сбраживание барды комплексом бактерий, сгущение метановой бражки и сушку сгущенной массы на распылительной сушилке. Брожение проводят в железобетонных ферментерах непрерывным способом в течение года.
Важное условие нормального процесса брожения — контроль уровня жирных кислот и аммонийного азота. Витамин В12 неустойчив при тепловой обработке, особенно в щелочной среде. Поэтому перед выпариванием к метановой бражке добавляют НСl до оптимального значения рН 5,0 — 5,3 и сульфит (оптимальное содержание 0,07 — 0,1 %). Перед поступлением на установку выпаривания метановая бражка дегазируется путем нагревания до 90 — 95°С при атмосферном давлении. Бражку сгущают до 20% сухих веществ в четырехкорпусных выпарных аппаратах. Сгущенная метановая бражка высушивается на распылительной сушилке.
Сухой концентрат КМБ-12, помимо витамина В12 (100 мг/кг препарата), содержит ряд других ростстимулирующих веществ. Особенно хорошие результаты в животноводстве получают при сочетании витамина В12 с малыми дозами антибиотиков, в частности, с биомицином.
См. также:
Дополнительно:
Технология получения витамина В12
Витамин В12 получают путем микробиологического синтеза из Propionobacterium, а также Pseudomonas и смешанных структурных бактерий.
Основной метод включает использование Propionobacterium. Процесс ведут в реакторе объемом 1 м 3 при коэффициенте заполнения 0,65-0,7.
Технология получения В12 включает две стадии:
1) перемешивание в реакторе в течение 80-88 ч в анаэробных условиях до полной утилизации сахара, после чего полученную массу центрифугируют;
2) процесс обработки суспензии во втором аппарате, уже при доступе воздуха; расход воздуха составляет 2м 3 /ч (рис. 6.10). Для питательной среды используют глюкозу, до 10% солей железа, марганца, магния и кобальта (концентрация соли колеблется от 10 до 100 мг/л), сульфат аммония.

Выход кристаллического витамина В12 составляет 40 мг/л.
Разработана также технология получения В12 из термических бацилл. Bacillus Circulans в течение 18 ч при температуре 65-75°C в нейтральных условиях. Выход витамина составляет 2-6 мг/л.
Источник:
Разговоров, П.Б.. Технология получения биологически активных веществ: учеб. пособие / П.Б. Разговоров; Иван. гос. хим.-технол. ун-т. — Иваново,2010. — 72 с.. 2010
При наличии желания более подробно ознакомиться с некоторыми нюансами биосинтеза В12 и его промышленного производства рекомендуем к изучению обзорный материал: Piwowarek K, Lipińska E, Hać-Szymańczuk E, Kieliszek M, Ścibisz I. Propionibacterium spp.-source of propionic acid, vitamin B12, and other metabolites important for the industry . Appl Microbiol Biotechnol. 2018 Jan;102(2):515-538.
Ультразвуковая модуляция метаболической активности Propionibacterium freudenreichii subsp. shermanii при получении пищевых продуктов, обогащённых витамином В12
Витамин В12 – одно из важнейших биологически-активных соединений, участвующих во многих процессах в организме человека. В современных условиях жизни часто наблюдается его дефицит, из-за чего необходимо введение в рацион специальных обогащѐнных продуктов. Однако его синтез очень сложен и в настоящее время он является одним из наиболее дорогостоящих витаминов. Статья посвящена модуляции ультразвуком метаболизма основного промышленного продуцента витамина В12 Propionibacterium shermanii с целью повышения эффективности биотехнологического процесса его производства.
Витамин В12 – группа кобальтсодержащих биологически-активных корриноидных соединений, известных как кобаламины. Он также известен как экзогенный (внешний) фактор Кастла, или животный белковый фактор. Витамин В12 осуществляет биокаталитические реакции, обеспечивающие кроветворную функцию организма. Он также способствует нормализации функции печени, благоприятно влияет на регенерацию нервных волокон и активирует созревание форменных элементов крови [2]. Наиболее важными для производства кобаламинами являются цианокобаламин и оксикобаламин благодаря своей стабильности при хранении и высокой биологической активности. Всасывание витамина происходит в тонком кишечнике после взаимодействия в желудке с гастромукопротеином — «внутренним фактором Кастла», который секретируется клетками слизистой оболочки желудка и обеспечивает его абсорбцию. Основным источником витамина являются пищевые продукты животного происхождения, а также микрофлора желудка и кишечника. В организме человека кишечные бактерии также синтезируют витамин В12, но в обычных условиях осуществляют этот синтез в тех областях, где всасывание витамина в кровь не происходит, так как не происходит связывание витамина с внутренним фактором, поэтому основное его количество должно поступать с пищей [2]. В12-гиповитаминоз может возникать при различных обстоятельствах: длительном вегетарианском питании, беременности, хроническом алкоголизме, а также в связи с различными нарушениями его усвоения при заболеваниях желудочно-кишечного тракта, а относительная алиментарная недостаточность витамина наблюдается практически повсеместно, что может быть исправлено введением в рацион специальных обогащѐнных витамином В12 пищевых продуктов. Однако химический синтез витамина В12 отличается высокой сложностью, и в настоящее время его производят биотехнологическими методами.
Одним из важнейших продуцентов витамина являются пропионовокислые бактерии. Морфологически это неподвижные бесспоровые палочки разной величины, от коккообразных до длинных, располагаются единично, парами или короткими цепочками, способные расти как в анаэробных, так и в аэробных условиях. Они активно сбраживают глюкозу, сахарозу, лактозу и пентозы, благодаря чему способны активно развиваться на различных субстратах, например в молочной сыворотке [6]. В клетках Propionibacterium shermanii корриноиды находятся в 5′-аденозильной форме, в виде которой они проявляют свое биокаталитическое действие и осуществляет метаболические функции и в организме человека, однако для их максимального накопления в культуральной среде необходимо создавать специальные условия культивирования [3].
Одним из способов направленного изменения метаболизма в клетках бактерий является обработка жидких сред ультразвуком, под действием которого ускоряются реакции механохимического происхождения, имевшие место в озвучиваемой среде до воздействия ультразвука и инициируются специфические сонохимические реакции, в основе которых лежит механизм разрыва химических связей и образования свободных радикалов [1].
Таким образом, с помощью ультразвуковой обработки можно проводить направленную модуляцию метаболической активности бактерий для обеспечения увеличения конечного выхода витамина В12 без увеличения длительности производственного процесса [5]. Для определения влияния ультразвука на метаболизм бактерий производилось культивирование клеток штамма Propionibacterium freudenreichii ssp. shermanii I-63, используемого в промышленном производстве витамина В12, в субстрате на основе восстановленной молочной сыворотки с концентрацией лактозы 5%, а также добавками 0,002% CoCl2·6H2O и 0,001% MgSO4. рН в процессе культивирования удерживался на уровне порядка 6,9 с помощью периодической нейтрализации среды.
Во время культивирования раз в сутки производилось кратковременное озвучивание сред ультразвуком низкой интенсивности и различной частоты. Для исследования метаболической активности бактерий в процессе культивирования были выбраны метод определения титруемой кислотности для определения количества синтезируемых бактериями органических кислот, по результатам титрования выяснено, что обработка ультразвуком вызывает повышение титруемой кислотности, причѐм на частоте 20 КГц этот эффект более выражен, чем на 22 КГц при одинаковой интенсивности облучения. Следующим этапом был выбор длительности озвучивания; при этом производилось культивирование пропионовокислых бактерий на аналогичной среде с обработкой субстрата ультразвуком на частоте 20 КГц в течение 10 и 20 минут каждые 24 часа.
Для сравнения различных режимов обработки использовались метод определения титруемой кислотности и спектрофотометрический метод для мониторинга состава сброженной сыворотки [4], а также микроскопический метод для сравнения морфологии клеток.
 |  |  |