СИНТЕЗ КОЛЛАГЕНА
Поможем написать любую работу на аналогичную тему
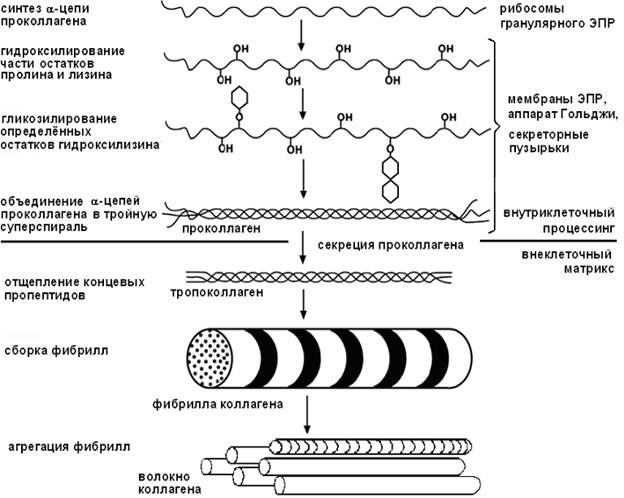
Существуют 8 этапов биосинтеза коллагена: 5 внутриклеточных и 3 внеклеточных.
Протекает на рибосомах, синтезируется молекула-предшественник: препроколлаген.
С помощью сигнального пептида “пре” транспорт молекулы в канальцы эндоплазматической сети. Здесь отщепляется “пре” — образуется “проколлаген”.
Аминокислотные остатки лизина и пролина в составе молекулы коллагена подвергаются окислению под действием ферментов пролилгидроксилазы и лизилгидроксилазы..
При недостатке витамина “С” — аскорбиновой кислоты наблюдается цинга, — заболевание, вызванное синтезом дефектного коллагена с пониженной механической прочностью, что вызывает, в частности, разрыхление сосудистой стенки и другие неблагоприятные явления.
Посттрасляционная модификация — гликозилирование проколлагена под действием фермента гликозилтрансферазы. Этот фермент переносит глюкозу или галактозу на гидроксильные группы оксилизина.
Заключительный внутриклеточный этап — идет формирование тройной спирали — тропоколлагена (растворимый коллаген). В составе про-последовательности — аминокислота цистеин, который образует дисульфидные связи между цепями. Идет процесс спирализации.
Секретируется тропоколлаген во внеклеточную среду, где амино- и карбоксипротеиназы отщепляют (про-)-последовательность.
Ковалентное “сшивание” молекулы тропоколлагена по принципу “конец-в-конец” с образованием нерастворимого коллагена. В этом процессе принимает участие фермент лизилоксидаза (флавометаллопротеин, содержит ФАД и Cu). Происходит окисление и дезаминирование радикала лизина с образованием альдегидной группы. Затем между двумя радикалами лизина возникает альдегидная связь.
Лизилоксидаза является Cu-зависимым ферментом, поэтому при недостатке меди в организме происходит уменьшение прочности соединительной ткани из-за значительного повышения количества растворимого коллагена (тропоколлагена).
Ассоциация молекул нерастворимого коллагена по принципу “бок-в-бок”. Ассоциация фибрилл происходит таким образом, что каждая последующая цепочка сдвинута на 1/4 своей длины относительно предыдущей цепи.
Только после многократного сшивания фибрилл коллаген приобретает свою уникальную прочность, становится нерастяжимым волокном.
Рисунок 3
Катаболизм коллагена
Нативный коллаген не гидролизуется обычными пептидгидролазами, основной фермент катаболизма коллагена — коллагеназа. Коллаген — медленно обменивающийся белок, о скорости его обмена судят по содержанию оксипролина в крови и моче. Катаболизм коллагена более активен в молодом возрасте (до 20 лет) и при некоторых заболеваниях (коллагенозы, гиперпаратиреоидизм, некоторые инфекционные заболевания).
Эластические волокна
2-й вид волокон — эластические. В основе строения — белок эластин. Эластин еще более гидрофобен, чем коллаген. В нем до 90% гидрофобных аминокислот.
Эластин — это основной структурный компонент эластических волокон, которые содержатся в тканях, обладающих значительной эластичностью (кровеносные сосуды, связки, легкие). Свойства эластичности проявляются высокой растяжимостью этих тканей и быстрым восстановлением исходной формы и размера после снятия нагрузки. Эластин — гликопротеин с молекулярной массой 70 кД, который содержит много гидрофобных аминокислот (Гли, Вал, Ала, Лей, Про). В отличие от большинства белков пептидные цепи эластина не приобретают характерную третичную структуру, а сохраняют гибкую случайную конформацию (рис.5).
В межклеточном матриксе молекулы эластина образуют волокна, сети, слои, в которых отдельные молекулы связаны множеством сшивок.
Наличие гибкой случайной конформации молекул эластина и большого количества поперечных сшивок позволяет эластическим волокнам проявлять свои резиновоподобные свойства.
Клеточные элементы соединительной ткани
Это фиброблсты, тучные клетки, макрофаги. В них происходят процессы синтеза структурных компонентов, а также процесс распада соединительной ткани. Коллаген обновляется на 50% за 10 лет. В фибробластах идут синтетические процессы: синтез коллагена, эластина.
Источник
Краткий обзор некоторых кофакторов, участвующих в синтезе коллагена
Качественные коллагеновые волокна — одна из основных составляющих здоровой кожи. Поэтому большое количество косметологических методов направлено на восстановление ее коллагенового каркаса. Как витамины и микроэлементы могут влиять на синтез коллагена? И почему для достижения стойкого эффекта необходимо учитывать их количественный состав в организме?
Ежегодно создаются новые методики и препараты для улучшения синтеза коллагена с целью профилактики инволюционных процессов в организме и уменьшения выраженности возрастных изменений.
Но за стремлением повлиять на коллагеногенез извне порой забывают о тех веществах, без достаточного количества которых в самом организме синтез коллагена крайне затруднен. Никто не будет отрицать, что продукция этого жизненно важного белка зависит от гормонов, гормоны, в свою очередь, от присутствия металлов, усвоение металлов — от витаминов; и эту цепочку можно продолжать долго, тем более что она замкнутая. Осветить все нюансы в одной статье не представляется возможным, но сделать шаг навстречу пониманию некоторых процессов — в наших силах. Синтез и процессинг (созревание) коллагена включает в себя несколько этапов:
- транскрипция генов, кодирующих коллагены, в которой участвуют десятки магнийи кальцийзависимых белков;
- синтез препроколлагена на рибосоме, поддерживаемый магний- и кальцийзависимыми белками;
- транспорт цепи препроколлагена в эндоплазматический ретикулум посредством сигнального пептида на N-концевом участке аминокислотной цепи;
- удаление сигнального пептида в препроколлагене посредством фермента пептидазы;
- гидроксилирование аминокислотных остатков пролина с участием Fe2+ и аскорбат-аниона в качестве кофакторов;
- гликозилирование моносахаридами аминокислотных остатков лизина в препроколлагене в присутствии ферментов, содержащих ионы марганца;
- сборка тройной спирали проколлагена из 3 аминокислотных цепей препроколлагена;
- внесение необходимых конформационных изменений в проколлаген посредством изомеризации остатков цистеина и пролина;
- упаковка проколлагена в транспортный везикул, перенос во внеклеточный матрикс;
- вне клетки модификация молекулы проколлагена с помощью протеиназ проколлагена, нуждающихся в ионах Zn2+ как кофакторе;
- формирование коллагеновых фибрилл из тропоколлагена посредством лизилоксидазы, кофакторами которой являются ионы Cu+ и тирозил-хинон (рис. 1) [1].
Всем известно об участии магния и кальция в синтезе соединительной ткани и коллагена, но о железе, цинке, меди, витаминах С и D часто забывают. Именно эти кофакторы рассмотрим в статье.
Железо
Железодефицитная анемия в той или иной степени присутствует у 40–60 % женщин детородного возраста по всему миру [2, 26]. И это при том, что железо — один из важнейших микроэлементов, необходимых для нормального функционирования биологических систем организма. Оно требуется для осуществления функции дыхания, кроветворения, участвует в иммунобиологических и окислительно-восстановительных реакциях.
Причины дефицита железа:
- недостаточное поступление в организм железа из-за нарушения режима питания (например, при вегетарианской диете);
- снижение всасываемости железа в кишечнике (рис. 3);
- нарушение регуляции обмена витамина С;
- избыточное поступление в организм фосфатов, оксалатов, кальция, цинка, витамина Е;
- поступление в организм железосвязывающих веществ;
- усиленное расходование железа (в периоды интенсивного роста и беременности);
- потери железа, связанные с травмами, кровопотерями во время операций, обильными менструациями, язвенными болезнями, донорством, занятиями спортом;
- нарушение функции щитовидной железы;
- различные системные и опухолевые заболевания [21].
Учитывая высокую распространенность дефицита железа в популяции, сложно говорить о нормальном синтезе коллагена при таких состояниях.
Цинк — единственный металл, представленный в небелковой части ферментов каждого класса, и никаким другим металлом цинк не может быть заменен. Несмотря на малую концентрацию цинка в крови, стабильные связи с макромолекулами делают его доступным для всех тканей организма, что в дальнейшем позволяет удовлетворять потребности в нем белков и ферментов, выполняющих различные биологические функции [28].
Распространенность дефицита цинка в мире не менее значительная, чем железа и витамина С, и составляет до 60% [29].
Для транспорта эритроцитами кислорода и углекислого газа абсолютно необходим цинк, и большая часть цинка крови содержится именно в эритроцитах в составе цинковых металлоферментов — карбоангидраз. Карбоангидразы катализируют превращения углекислого газа в угольную кислоту (угольная кислота участвует в поддержании pH крови в физиологическом диапазоне (7,25–7,35). В капиллярах легких эти процессы идут в обратном направлении: угольная кислота распадается на углекислый газ и воду, и углекислый газ удаляется наружу [18].
Без нормального дыхания ни одна клетка не способна осуществлять свои функции.
В мире распространенность дефицита меди в организме, приводящего, наряду с железом, к анемии, составляет до 30%. А ведь этот микроэлемент крайне необходим для нормальной физиологии организма.
Если говорить о коже, то медь играет ключевую роль в ангиогенезе, синтезе и стабилизации белков внеклеточного матрикса [3].
В физиологически значимых концентрациях (2 мг — средняя суточная потребность) медь ускоряет заживление ран [16].
Ионы меди, которые являются кофакторами лизилоксидазы, принимают участие в последнем этапе синтеза коллагена. Медь имеет важное значение для формирования внутри- и межмолекулярных поперечных связей в коллагене, а соответственно, и прочности коллагеновых и эластиновых фибрилл [8, 13, 15]. Недостаток меди ухудшает формирование сшивок коллагена и приводит к тяжелой патологии костей, легких и сердечно-сосудистой системы [12].
Компенсация дефицита этого микроэлемента, бесспорно, улучшает синтез коллагена, в том числе в коже (рис. 4) [7, 10].
Аскорбиновая кислота (витамин С)
Аскорбиновая кислота играет в организме фундаментальную роль — нет фактически ни одного физиологического процесса, в котором бы она не принимала участия.
Роль витамина С в организме
Аскорбиновая кислота в организме человека оказывает влияние на множество важнейших биологических процессов:
- образование кортикостероидов (при стрессе в несколько раз возрастает уровень потребления витамина С тканями и органами) [20];
- обмен тирозина (влияние на обмен гормонов щитовидной железы) [22];
- трансформация дофамина в норадреналин [25];
- превращение токсичных соединений ванадия в безвредные [23];
- превращение фолиевой кислоты в ее активную форму — тетрагидрофолат [27];
- активация мРНК ацетилхолинового рецептора [20];
- образование активных форм витамина D (транспортной формы [25(OH)D] — в печени и активной гормональной формы [1,25(ОН)2D] — в почках), что служит основным фактором профилактики остеопороза [20];
- потенцирование всасывания железа [24].
Распространенность дефицита витамина С в мире по разным данным составляет 20–40% [14, 15].
В последнее время много исследований посвящено аскорбиновой кислоте и ее биодоступности для кожи [9]. При недостатке витамина С в организме его нанесение на кожу не будет иметь ожидаемого эффекта, так как не сможет восполнить нутритивный дефицит. В ходе проведенных исследований выяснилось, что витамин С ускоряет заживление ран, участвует в активизации синтеза коллагена I типа (рис. 5) и снижении параметров окислительного стресса. Никаких значимых побочных эффектов при добавлении витамина С в питание в ходе проведенных исследований выявлено не было [5, 6].
Синтез коллагена зависит от гормонов, гормоны, в свою очередь, от присутствия металлов, усвоение металлов — от витаминов, и эту цепочку можно продолжать долго, тем более что она замкнутая.
Витамин D
Распространенность дефицита витамина D в российской популяции составляет более 90% (в мире 50–60%) [19]. Этот витамин стимулирует увеличение синтеза секретируемых белков TGF-β (регулируют деление
и дифференцировку различных типов клеток, включая фибробласты и кератиноциты) и их связывание с рецепторами на мембране клеток. Поэтому при его дефиците происходит нарушение активности сигнальных каскадов TGF-β, что ухудшает заживление кожи после любой травмы (включая косметологические манипуляции). Например, во время термолифтинга часть коллагеновых волокон дермы сжимается и уменьшается в объеме. Это приводит к повышению зернистости базального слоя и при достаточном количестве витамина D создает благоприятные условия для воздействия его активных форм на экспрессию TGF-β1, который и способствует обновлению соединительной ткани [11].
Выводы
Мы кратко обсудили лишь некоторые кофакторы, участвующие в синтезе коллагена. Но даже этот незначительный пласт информации позволяет судить о зависимости синтеза коллагена от нутритивного статуса организма, чем не следует пренебрегать, решая многие эстетические задачи. Изменение синтеза коллагена происходит постепенно и усугубляется нутритивным дефицитом [19].
Источник
Синтез коллагена



На примере коллагена -I: характерен для кости, является основным белком дентина. (закрепляем материал по пост трансляционному процессингу белка и ферментам микросомального окисления)
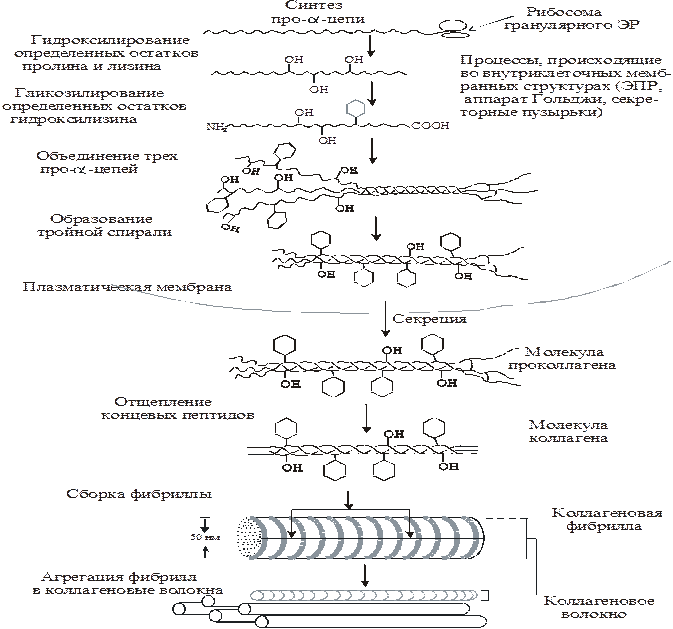
Коллаген синтезируется в фибробластах в виде высокомолекулярного предшественника – проколлагена.
На этапах синтеза коллагена после включения пролина и лизина в полипептидную цепь происходит их гидроксилирование (специфично для молекулы коллагена). Образование гидроксипролила и гидроксилизила катализируют железосодержащие ферменты — пролилгидроксилаза и лизилгидроксилаза, их кофактор — аскорбиновая кислота. Гидроксилирование аминокислот является диоксигеназной реакцией, т.е. молекула кислорода одновременно окисляет два субстрата (аминокислоту и a-кетоглутарат):
 |
В результате реакции образуются оксипролин и сукцинат (в молекулу которого включён второй атом кислорода из молекулы О2) и выделяется СО2. Реакция высокоспецифична – остатки пролина и лизина подвергаются гидроксилированию, если они расположены со стороны аминогруппы глицинового остатка. Аскорбиновая кислота работает как восстановительный агент, благодаря которому железо в активном центре фермента сохраняется в форме Fe 2+ . При недостатке витамина С синтез коллагена нарушается, возникает непрочность коллагеновых волокон, кровоточивость десен, расшатывание зубов (проявления цинги). Расшатывание зубов обусловлено, главным образом, недогидроксилированием вновь синтезированного коллагена периодонтальной связки. Такой коллаген плохо агрегирует.
К остаткам гидроксилизина под действием сначала галактозилтрансферазы, затем глюкозилтрансферазы присоединяются углеводные единицы (сначала – одна галактоза, затем некоторые галактозы достраиваются до дисахарида – галактоза-глюкоза).
Гидроксилирование и трансферазная реакция происходят во вновь синтезированном коллагене, ещё не претерпевшем спирализации в просвете эндоплазматического ретикулюма. Затем каждая про-a-цепь с помощью водородных связей объединяется с двумя другими в молекулу проколлагена, которая секретируется в межклеточный матрикс.
• Проколлаген имеет более длинные цепи, чем тропоколлаген. Дополнительные концевые фрагменты не образуют обычную трехцепочечную спираль, а объединяются друг с другом в глобулярные домены, структура которых совершенно не похожа на уникальную линейную структуру зрелого коллагена (например, есть дисульфидные мостики). Это препятствует агрегации и образованию фибрилл внутриклеточно, что было бы фатальным для клетки. Вне клетки протеолитические ферменты последовательно удаляют оба домена – N-концевой и С-концевой (маркёры синтеза коллагена).
Ниже Более подробная схема синтеза коллагена
После того как во внеклеточном пространстве сформировались коллагеновые фибрилы, их прочность существенно увеличивается, так как образуются ковалентные сшивки между остатками лизина внутри и между молекулами тропоколлагена, укрепляя четвертичную структуру.
Сшивки создаются в несколько этапов.
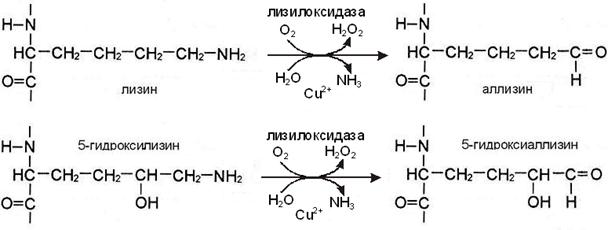
I этап. Вначале некоторые остатки лизина и гидроксилизина дезаминируются лизилоксидазой с образованием альдегидных групп, обладающих высокой реакционной способностью. Затем эти группы самопроизвольно реагируют с образованием ковалентных связей друг с другом или с другими остатками лизина или гидроксилизина.
II этап. Альдегидные группы самопроизвольно взаимодействуют друг с другом, образуя альдольные поперечные связи коллагена, или реагируют с аминогруппой остатков лизина или 5-гидроксилизина (рис. А), обеспечивая образование бифункциональных ковалентных сшивок между соседними молекулами тропоколлагена.
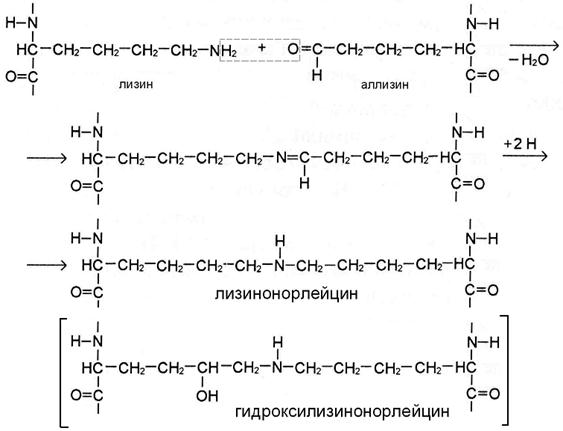
Если в реакции участвует аллизин, то она протекает по механизму альдиминной конденсации. При этом по иминной связи промежуточного соединения присоединяются 2 атома Н. В результате образуются сшивки с группировкой -NH- в середине – лизиннорлейцин или гидроксилизиннорлейцин (рис. А).

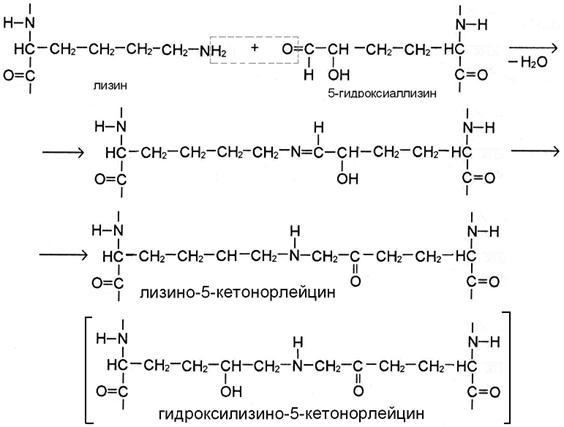
Присутствие гидроксильной группы в 5 положении гидроксиаллизина предопределяет течение реакции по механизму кетоиминной конденсации (рис Б). В этом случае в цепи получившейся поперечной сшивки лизино-5-кетонорлейцина или гидроксилизино-5-кетонорлейцина вместе с группировкой -NH- присутствует кето-группа.
Цепочки таких перемычек достаточно длинные, чтобы иметь некоторую гибкость, а ковалентное соединение атомов придаёт им высокую прочность и закрепляет регулярную структуру микрофибрилл коллагена.
Поперечные бифункциональные сшивки имеют свой вариант упорядоченности: каждый концевой телопептид тропоколлагена соединён перемычкой с расположенным на том же уровне участком смежной молекулы (рис. 9). Подобная локализация и прочность сшивок позволяет обнаружить их в составе N- и C-телопептидов, отщепляемых при распаде коллагена (для идентификации таких специфичных фрагментов разработаны методы, основанные на иммуноферментном анализе).
Бифункциональные связки наиболее присущи фибриллообразующим коллагенам типа I, II и III, причём в зависимости от вида ткани преобладает какой-либо определённый вид сшивки.
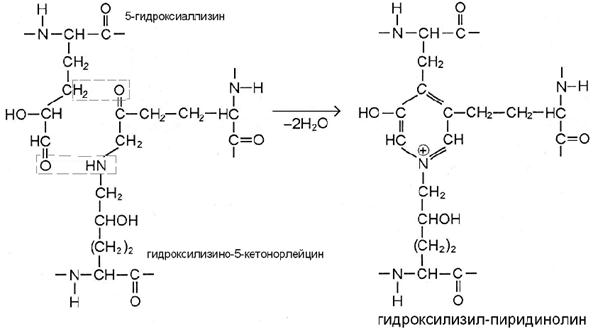
III этап. По мере созревания ткани возникают перемычки и между микрофибриллами. В бифункциональных сшивках сохраняются реакционноспособные атомы, которые постепенно вступают в реакции дополнительной конденсации с образованием трифункциональных сшивок, имеющих в центре гетероцикл – пиридиниевое или пиррольное кольцо (рис. В, Г). Эти процессы протекают также неферментативно путём спонтанного взаимодействия кетоиминной двойной сшивки одной микрофибриллы с альдегидным радикалом, расположенным в телопептидной части другой микрофибриллы.
Если в реакции участвуют 5-гидроксиаллизин и уже сформированная сшивка гидроксилизино-5-кетонорлейцина, то продукт – гидроксилизил-пиридинолин (рис. В).
В большинстве тканей это главная трифункциональная сшивка коллагенов.
В минерализуемых тканях (кость, ткани зуба) число пиридиниевых сшивок в 5-10 раз меньше, чем в хряще и сухожилиях, причём чаще всего здесь встречается лизил-пиридинолин – вариант с негидроксилированной цепочкой в перемычке, образованной с участием лизино-5-кетонорлейцина. Более того, для минерализованных тканей характерны сшивки пиррольного типа, которые образует негидроксилированный аллизин, соединяясь с бифункциональной сшивкой гидроксилизино-5-кетонорлейцином (рис. Г). Из всех трифункциональных перемычек для минерализуемых тканей специфичен именно гидроксилизилпиррол. Дополнительные перемычки циклического характера нужны для повышения механической прочности волокон коллагена.
Источник